D
?
2、选择题 20世纪90年代,国际上提出了“预防污染”的新概念。“绿色化学”是“预防污染”的基本手段,下列各项中属于“绿色化学”的是( )。
A.处理废弃物
B.杜绝污染源
C.减少有毒物
D.治理污染点
3、选择题 下列说法错误的是:
A.缺铁易患贫血病
B.聚氯乙烯塑料不可用来包装食品
C.皮肤被烫伤或受浓硝酸腐蚀时,细胞结构将受到破坏
D.由于淀粉在人体中会转化为氨基酸,因此每天都要摄入一定量的淀粉
4、计算题 (12分)进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡。
(1)25℃时,已知胃液的pH在0.9—1.5之间,请问___??????。(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由_???????????????。
(2)当人体中Ba2+浓度达到2×10-3mol·L-1时,就会对健康产生危害,若误将氯化钡当做食盐食用,请计算说明是否可以通过服用5%的硫酸钠溶液(约0.36mol·L-1)有效除去胃中的Ba2+。(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
?????????????????????????????????????????????????????????????????????????????。
 (3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为: (3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
① Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;② I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。
5、填空题 如图所示,在一条鱼、虾几乎绝迹的小河边,从上游到下游依次有甲、乙、丙、丁四座工厂,各厂排放的废水里都只含有Na2CO3、FeCl3、Ca(OH)2、HCl中的一种。某中学环保小组对河水监测时发现:①甲处河水呈乳白色;②乙处河水呈红褐色;③丙处河水由浑变清;④丁处产生气泡,河水仍澄清。请回答:
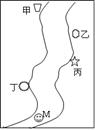
⑴ 四座工厂排出的废水里含有的污染物分别为:
甲??????????;乙??????????;
丙??????????;丁??????????。(填化学式)
⑵ 在丁的下游M处取出的河水中,肯定含有的离
子是?????????????????????????????????????????。
⑶ 写出有关反应的离子方程式:??????????????????????????????。
⑷ 小河中鱼、虾几乎绝迹的原因是????????????????????????????。
| 


