时间:2017-01-19 10:29:07
1、填空题 水处理主要包括水的净化、污水处理、硬水软化和海水淡化等。
(1)水处理技术的核心是减少或除去水中的各种杂质离子。目前________和________是主要的去离子方法。
(2)ClO2是一种性能优良的消毒剂,可将废水中少量的S2-、NO2-和CN-等有毒有害的还原性离子氧化除去。请写出ClO2将废水中剧毒的CN-氧化成无毒气体的离子方程式________。
(3)地下水往往含有钙、镁的碳酸盐,自来水厂需要对地下水进行________处理。把进行过离子交換的CaR2(或MgR2)型树脂置于______中浸泡一段时间后便可再生。
(4)海水的淡化是除去海水中所含的盐分,右面是海水利用电渗析法获得淡水的原理图,已知海水中含有Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请回答: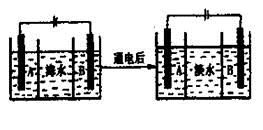
①阳离子交换膜是指________(填“A”或“B”)。
②写出通电后阳极区的电极反应式________________。
参考答案:(1)离子交换法???膜分离法
(2)2CN-+2Cl
本题解析:(1)水处理的核心是减少或处理水中的各种杂质,采用的主要方法是,离子交换法、膜分离法。
(2)ClO2具有强氧化性,CN-中的碳被氧化成CO2,氮容易被还原为N2,方程式为2CN-+2ClO2=2CO2↑+N2↑+2Cl-。
(3)地下水硬度很大,需要软化,则自来水有厂需要对地下水进行软化,阳离子交换树脂可以实现阳离子之间的交换,阴离子交换树脂交换出H+离子,生成CaR2,可用盐酸或酸溶液使阴离子交换树脂再生。
(4)①阴离子交换树脂只允许阴离子自由通过,阳离子交换树脂只允许阳离子自由通
本题难度:一般
2、选择题 工业上制取硫酸铜不是直接用浓硫酸与铜反应,而是将铜丝浸入稀硫酸中并不断地从容器下部吹入细小的空气泡,这样做的优点是( )。
①节省能源 ②不产生污染大气的SO2 ③提高了H2SO4的利用率 ④提高了Cu的利用率
A.①②
B.②③④
C.①②③
D.全部
参考答案:C
本题解析:浓硫酸直接与铜反应:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,需要加热,产生污染大气的SO2气体并且H2SO4利用率低。而将铜丝浸入稀硫酸中并吹入空气不存在这些问题,反应方程式为2Cu+O2+2H2SO4(稀)
CuSO4+SO2↑+2H2O,需要加热,产生污染大气的SO2气体并且H2SO4利用率低。而将铜丝浸入稀硫酸中并吹入空气不存在这些问题,反应方程式为2Cu+O2+2H2SO4(稀)本题难度:简单
3、选择题 化学实验小组在学习化学电源和氯碱工业相关知识后,在实验室进行实验验证,他们设计组装了如下图所示装置,已知a为石墨电极;b为铁电极;c为铝电极(已除去表面氧化膜);d为多孔石墨电极,烧杯中是足量饱和食盐水(滴有酚酞),连好导线后,电流计指针发生明显偏转。下列判断正确的是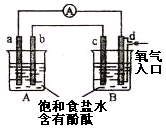
A.b为负极,d为阳极
B.一段时间后,a和d电极附近溶液变红
C.b电极电极反应式为:2Cl-—2e-=Cl2↑
D.当电解一段时间,B中出现大量白色沉淀时,停止实验,再将A中溶液倒入B中混合,充分振荡,沉淀全部消失
参考答案:D
本题解析:根据装置可得出A是电解池,B是原电池,其中c是负极,反应式为4Al-12e-+12OH-=4Al(OH)3↓。d是正极,反应式为3O2+6H2O+12e-===12OH-。a是阳极,反应式为2Cl-—2e-=Cl2↑。b是阴极反应式为2H++2e-=H2↑。A、C不正确,一段时间后,b和d电极附近溶液变红,B不正确。根据电荷守恒知,当B中生成4mol氢氧化铝沉淀时,转移12mol电子,此时A中将生成12mol氢氧化钠,由反应式A(OH)3+NaOH=NaAlO2+2H2O可看出选项D正确。答案是D。
本题难度:一般
4、填空题 (10 分)SO2和NOx的排放是造成酸雨的两大罪魁祸首。下图表示了某地区在1940~2002年间,空气中SO2和NOx含量因燃料燃烧、工业生产、交通运输以及其他因素的影响而发生变化的基本统计数据。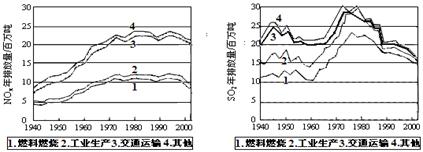
(1)结合上图数据,判断下列说法正确的是?? ▲??。
A.在交通运输中排放的NOx与燃料的不充分燃烧有关
B.在上世纪60年代以前,在交通运输中排放的SO2主要是使用燃煤的内燃机所致
C.近年来在工业生产中SO2排放量的下降,主要是减少了燃烧的煤的质量
D.随着汽车工业的发展,在形成酸雨的因素中,NOx所占比重在逐渐增大
(2)在上图表示的历史进程中,由工业生产所导致的SO2的排放量明显地在逐年减少。请用化学方程式说明人类在为解决SO2污染问题中所进行的一个反应过程:
?? ▲??。
(3)汽车排放的尾气中含有未燃烧充分的CmHn、以及N2、CO2、NO、CO等。有人设计利用反应2NO + 2CO  ?N2 + 2CO2将有害的污染物转化为可参与大气循环的N2和CO2。
?N2 + 2CO2将有害的污染物转化为可参与大气循环的N2和CO2。
在某温度下用气体传感器测得不同时间的NO和CO浓度如表:
| 时间/h | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol·L-1 | 1.00×10-3 | 4.5×10-4 | 2.5×10-4 | 1.5×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol·L-1 | 3.6×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3    在上述条件下反应能够自发进行,则反应的 在上述条件下反应能够自发进行,则反应的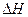 ?? ▲??0(“>”、“<”、“=”)。 ?? ▲??0(“>”、“<”、“=”)。 在该温度下,反应的平衡常数K=?? ▲??。 在该温度下,反应的平衡常数K=?? ▲??。(4)某次降雨过程收集到10L的雨水,向雨水中滴加1mL6mol/L的H2O2,充分反应后测得溶液的pH="3.62" [c(H+) =2.4×10-4 mol/L ]),再向溶液中加入足量的Ba(OH)2溶液,经过滤、晾干、称重,得沉淀的质量为0.1864g。若假设雨水的酸性仅由NOx和SO2的排放所致。请计算排放在空气中的NOx和SO2的物质的量之比接近于?? ▲??。 参考答案:(1)BD 本题解析:略 本题难度:一般 5、选择题 下列哪种燃料直接燃烧对环境污染最严重 参考答案:A 本题解析:略 本题难度:一般 |