A.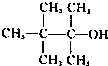
B.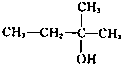
C.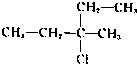
D.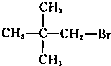
参考答案:A
本题解析:
本题难度:简单
2、选择题 常温下,电解质溶液的性质与变化是多样的,下列说法正确的是
A.pH相同的①CH3COONa ②NaClO ③NaOH三种溶液c(Na+)大小:①>②>③
B.往稀氨水中加水,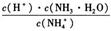 的值变小
的值变小
C.pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,存在下列等式:c(Na+)+c(H+) = C(OH—)+2c(S2—)
D.Ca(ClO) 2溶液中通入少量CO2,ClO—水解程度增大,溶液碱性增强
参考答案:A
本题解析:
试题分析:A、CH3COONa与NaClO水解显碱性,根据越弱越水解的规律,若溶液的pH相同,CH3COONa的浓度最大,所以三种溶液c(Na+)大小顺序为:①>②>③,故A正确;B、NH3?H2O的电离常数K=c(NH4+)
?c(OH?)/c(NH3?H2O)= c(NH4+)?Kw /c(NH3?H2O)?c(H+),所以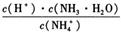 的值为常数,不发生变化,故B错误;C、因为H2S为弱酸,所以pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,H2S过量,根据电荷守恒可得:c(Na+)+c(H+) = C(OH—)+2c(S2—)+c(HS?),故C错误;D、Ca(ClO) 2溶液中通入少量CO2,生成CaCO3与HClO,溶液碱性减弱,故D错误。
的值为常数,不发生变化,故B错误;C、因为H2S为弱酸,所以pH=4的H2S溶液与pH=10的NaOH溶液等体积混合,H2S过量,根据电荷守恒可得:c(Na+)+c(H+) = C(OH—)+2c(S2—)+c(HS?),故C错误;D、Ca(ClO) 2溶液中通入少量CO2,生成CaCO3与HClO,溶液碱性减弱,故D错误。
考点:本题考查弱电解质的电离平衡、离子浓度比较、盐类的水解。
本题难度:困难
3、选择题 在55 ℃时,下列说法正确的是
A.向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变
B.pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L
C.饱和氯水中: c(Cl-)=c(ClO-)+c(HClO)
D.0.1 mol/L的(NH4)2SO4溶液中:c(SO42-)>c(NH4+) >c(H+)>c(OH-)
参考答案:C
本题解析:
试题分析:A.硫酸氢钠溶液完全电离,电离出的H+抑制水的电离,A项错误;B.Kw=1×10-14mol2/L2是在常温下的数值,而此时温度为55 ℃,无法确定Kw的值,进而无法计算OH-的浓度,B项错误;C.在饱和氯水中存在Cl2+H2O HCl+HCl0,根据物料守恒,c(Cl-)=c(ClO-)+c(HClO),C项正确;D.(NH4)2SO4溶液中存在(NH4)2SO4 =2NH4+ +SO42-,所以c(NH4+ )>c(SO42-),D项错误;选C。
HCl+HCl0,根据物料守恒,c(Cl-)=c(ClO-)+c(HClO),C项正确;D.(NH4)2SO4溶液中存在(NH4)2SO4 =2NH4+ +SO42-,所以c(NH4+ )>c(SO42-),D项错误;选C。
考点:考查电解质溶液中离子浓度的大小比较。
本题难度:一般
4、填空题 欧盟原定于2012年1月1日起征收航空碳排税以应对冰川融化和全球变暖,使得对如何降低大气中CO2的含量及有效地开发利用碳资源的研究显得更加紧迫。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:

(2)焦炭可用于制取水煤气。测得12 g 碳与水蒸气完全反应生成水煤气时,吸收了131.6 kJ热量。该反应的热化学方程式为 。
(3)活性炭可处理大气污染物NO。在2 L密闭容器中加入NO和活性炭(无杂质),生成气体E和F。当温度分别在T1和T2时,测得各物质平衡时物质的量如下表:

上述反应T1℃时的平衡常数为K1,T2℃时的平衡常数为K2。
Ⅰ.计算K1= 。
Ⅱ.根据上述信息判断,温度T1和T2的关系是(填序号) 。

(4)CO2经常用氢氧化钠来吸收,现有0.4 molCO2,若用200ml 3mol/LNaOH溶液将其完全吸收,溶液中离子浓度由大到小的顺序为: 。
(5)CO还可以用做燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和 Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混和气为正极助燃气,制得在 650 ℃下工作的燃料电池,其负极反应式: 则
则
正极反应式:___ ,电池总反应式 。
参考答案:(1)5、4、6、5、4、2、6(2)C(s)+H2O(g)
本题解析:
试题分析:(1)反应中C元素的化合价由0升高为+4价,一个碳化合价变化4,Cr元素的化合价由+6价降低为+3价,1个K2Cr2O7化合价变化6,4和6的最小公倍数为12,由化合价升降总数相等可知,C的化学计量数为3,K2Cr2O7的化学计量数为2,由于产物中有Cr2(SO4)3,所以未知的反应物为H2SO4,最后由质量守恒定律可知得化学反应为3C+2K2Cr2O7+8H2SO4
本题难度:困难
5、填空题 (14分)某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。
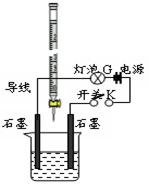
(1)实验时,烧杯中应盛 (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ,原因是 。烧杯中得到的溶液pH= 。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“⑵”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_ _。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是_ _____(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
参考答案:⑴ B
⑵ 5&#
本题解析:
试题分析:⑴图中为酸式滴定管,所以烧杯中应盛碱溶液B;⑵当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,恰好完全反应,生成一元强酸强碱盐,离子数目与原B溶液中相等,体积约为原来2倍,离子的浓度约为原溶液的一半,导电能力约为原来1/2,溶液为中性pH=6.5。(3)溶液为中性时,溶液中阳离子浓度大于阴离子浓度,可能A为多元强酸;⑷a+b=13说明酸中c(H+)与碱中c(OH-)相等,二者混合后溶液呈碱性,说明碱为弱碱,所以碱过量,弱碱阳离子M+水解,水解反应的离子方程式为M++H2O 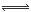 MOH+H+;由于溶液呈碱性,c(OH-)>c(H+),①、③错误,根据c(OH-)>c(H+)和电荷守恒c(M+)+c(H+)=c(R-)+c(OH-)可得c(M+)>c(R-),因为OH-和H+均来自于弱电解质的电离,其浓度应该很小,故c(M+)>c(R-)>c(OH-)>c(H+),所以④正确,根据电荷守恒是关系,⑤正确,若HR是强酸,此时溶液中不再有HR分子,②是错误的,由于(3)的混合溶液中MOH有大量剩余,即c(MOH)>0,若⑥正确,则c(H+)>c(OH-),溶液显酸性,所以⑥错误。
MOH+H+;由于溶液呈碱性,c(OH-)>c(H+),①、③错误,根据c(OH-)>c(H+)和电荷守恒c(M+)+c(H+)=c(R-)+c(OH-)可得c(M+)>c(R-),因为OH-和H+均来自于弱电解质的电离,其浓度应该很小,故c(M+)>c(R-)>c(OH-)>c(H+),所以④正确,根据电荷守恒是关系,⑤正确,若HR是强酸,此时溶液中不再有HR分子,②是错误的,由于(3)的混合溶液中MOH有大量剩余,即c(MOH)>0,若⑥正确,则c(H+)>c(OH-),溶液显酸性,所以⑥错误。
考点:弱电解质在水溶液中的电离平衡、pH的简单计算、离子浓度大小比较。
本题难度:困难