时间:2017-01-19 09:59:53
1、选择题 根据下列物质的性质,判断其应用错误的是(???)
A.明矾水解时产生具有吸附性的胶体粒子,可作自来水的净水剂
B.CaO能与SO2反应,可作工业废气的脱硫剂
C.浓硫酸、浓硝酸具有强氧化性,在常温下可用铁、铝制容器来盛装浓硫酸或浓硝酸
D.铜的金属活泼性比铁的弱,可在海轮外壳上焊若干铜块以减缓其腐蚀
参考答案:D
本题解析:
试题分析:A、明矾水解时产生具有吸附性的胶体粒子,可作自来水的净水剂,正确;B、CaO能与SO2反应生成亚硫酸钙,进一步氧化为硫酸钙,可作工业废气的脱硫剂,正确;C、浓硫酸、浓硝酸具有强氧化性,常温下遇铁、铝钝化,在常温下可用铁、铝制容器来盛装浓硫酸或浓硝酸,正确;D、铜的金属活泼性比铁的弱,可在海轮外壳上焊若干铜块,形成原电池,铁作负极,发生氧化反应,加快其腐蚀,错误。
本题难度:一般
2、填空题 由某金属的混合物(含65%Cu、25%Al、8%Fe及少量Au、Pt)制备硫酸铜和硫酸铝晶体的路线设计如下:
已知物质开始沉淀和沉淀完全时pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 沉淀开始时pH | 2.7 | 4.1 | 8.3 |
| 沉淀完全时pH | 3.7 | 5.4 | 9.8 ? 请回答下列问题: (1)过滤操作用到的玻璃仪器有________。 (2)第①步Al与足量酸反应的离子方程式为___________________________, 得到滤渣1的主要成分为________。 (3)第②步用NaOH调节溶液pH的范围为________。 (4)由第③步得到CuSO4·5H2O晶体的步骤是将滤液2________、________、过滤、洗涤、干燥。 (5)现有洗涤后的滤渣2制取Al2(SO4)3·18H2O,请将a、b、c补充完整。 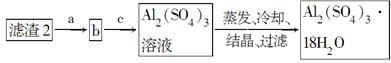 参考答案:(1)烧杯、玻璃棒、漏斗 本题解析:(1)进行过滤操作时需要用烧杯盛接滤液,用玻璃棒引流,用漏斗过滤。(2)Cu、Al、Fe、Au、Pt中加入稀硫酸和浓硝酸的混合物并加热时,Cu、Al、Fe都被氧化,硝酸浓度较高时生成NO2,硝酸浓度较低时生成NO,Au、Pt不反应,所以滤渣1为Au、Pt。(3)滤液1中含有Cu2+、Al3+、Fe3+,加入NaOH溶液调溶液pH的目的是实现Cu2+与Al3+、Fe3+的分离,当pH=5.4时,Cu2+没有沉淀,而Al3+、Fe3+沉淀完全,当pH=8.3时,Cu2+开始沉淀,所以调节溶液pH的范围为5.4 本题难度:困难 3、选择题 甲、乙是周期表中同一主族的两种元素,若甲的原子序数为x,则乙的原子序数不可能是 [???? ] 参考答案:B 本题解析: 本题难度:简单 4、选择题 月球表面土壤里的-种非常有用的资源--可控核聚变的原料,关于的叙述正确的是( ? ) |