时间:2017-01-19 09:53:38
1、选择题 以下有关下列三个化学反应的说法不正确的是(???? )
A.反应①②③都属于氧化还原反应
B.反应②中氧化剂还原剂均为KClO3,其中氧元素化合价降低
C.反应① H2作还原剂,在反应中被氧化
D.反应①中还原性:H2>Cu
参考答案:AB
本题解析:
试题分析:CaCO3与HCl反应没有化合价的变化,不属于氧化还原反应,A错误。KClO3受热分解,变价的除了有O元素外还有Cl,B错误。答案选AB。
点评:本题简单基础,主要考查氧化还原反应的基本概念。
本题难度:一般
2、填空题 硒元素具有抗衰老、抑制癌细胞的功能,其化学性质与硫相似.硒的元素符号为Se,相对原子质量为79,对应的某种含氧酸的化学式为H2SeO3.
(1)这种酸应读作______;
(2)若将二氧化硫通入H2SeO3的溶液中,会有Se析出,写出该反应的化学方程式:
______;
(3)又已知2HCl+H2SeO4═H2SeO3+Cl2+H2O,则H2SeO4、H2SeO3、H2SO3的氧化性由强到弱的顺序是______.
参考答案:(1)H2SeO3中Se的化合价为+4价,与H 2SO3类似,
本题解析:
本题难度:一般
3、选择题 已知下列分子或离子在酸性条件下都能氧化KI,自身发生如下变化:H2O2→H2O,IO3-→I2,MnO4-→
Mn2+,HNO3→NO。如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是[???? ]
A. H2O2
B. IO3-
C. MnO4-
D. HNO3
参考答案:B
本题解析:
本题难度:简单
4、实验题 为验证卤素单质氧化性的相对较弱,某小组用下图装置进行实验(夹持仪器已略去,气密性已检验)。实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸,A中产生黄绿色气体。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。
Ⅳ.……
(1)D中四氯化碳的电子式是 。
(2)验证氯气的氧化性强于碘的实验现象是 。
(3)B中溶液发生反应的离子方程式是 。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 。
(5)过程Ⅲ实验的目的是 。
参考答案:(1)本题解析:
试题分析:(1)四氯化碳是共价化合物,含有极性键,电子式是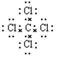 。
。
(2)氯气具有氧化性,能把碘化钾氧化生成单质碘,碘与淀粉性蓝色,所以实验现象是淀粉KI试纸变蓝。
(3)氯元素的非金属性强于溴元素的非金属性,所以氯气能和溴化钠反应生成单质溴,反应的离子方程式是Cl2+2Br- =Br2+2Cl-。
(4)由于C中有单质溴生成,所以要验证溴的氧化性强于碘,过程Ⅳ的操作和现象分别是打开活塞b,将少量C中溶液滴入D中,关闭活塞b,(取下D震荡) ,静置后CCl4层溶液(或下层溶液,1分)变为紫红色。
(5)由于氯气也能氧化碘化钾,干扰单质溴和碘化钾的反应,所以过程Ⅲ实验的目的是确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰。
考点:考查卤素元素非金属性强弱的实验探究、电子式以及方程式的书写
点评:该题是中等难度的试题,也是高考中的常见题型。试题贴近高考,难易适中,注重基础知识的考查和能力的训练。该类试题要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。
本题难度:困难
5、选择题 根据表中信息判断,下列选项不正确的是?? ( )。
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4…… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-…… | Cl2、Mn2+…… ? A.第①组反应的其余产物为H2O和O2 B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2 C.第③组反应中生成1 mol Cl2,转移电子2 mol D.氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2 参考答案:D 本题解析:本题考查氧化还原反应的相关知识。A项MnSO4是还原产物,H2O2作还原剂,氧化产物是O2,依据原子守恒,产物中还应有水,正确;B项,Fe2+的还原性强于Br-,Cl2与FeBr2的物质的量之比为1∶2时,1 mol Cl2恰好氧化2 mol Fe2+,Br-不被氧化,产物为FeCl3、FeBr3,正确;C项,MnO4-得电子转化为Mn2+,Cl2是氧化产物,只有Cl-失电子,生成1 mol Cl2转移2 mol电子,正确;D项,氧化产物的氧化性弱于氧化剂的氧化性,故氧化性MnO4->Cl2>Br2>Fe 本题难度:一般 |