时间:2017-01-19 02:08:32
1、选择题 在绿色化学工艺中,?理想状态是反应物中原子全部转化为欲制得产物,即原子的利用率为100%。在用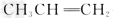 合成
合成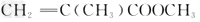 的过程中,欲使原子利用率达到最高,还需要其他的反应物有[???? ]
的过程中,欲使原子利用率达到最高,还需要其他的反应物有[???? ]
A.?CO2和H2O?
B. CO和HCHO?
C.?CH3OH和H2?
D.?H2和CO2??
参考答案:B
本题解析:
本题难度:简单
2、填空题 对金属制品进行抗腐蚀处理,可延长其使用寿命。以下为铝材表面处理的一种方法: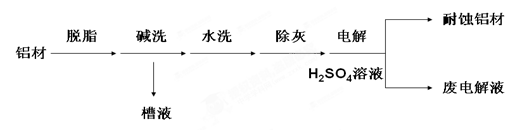
(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是 ???????????
(用离子方程式表示);
往废电解液中加入NaHCO3时会出现气泡,原因是????????(用离子方程式表示)
(2)为将碱洗槽液中的铝以沉淀形式回收,最好向槽液中加入下列试剂中的?????
A.NH3
B.CO2
C.NaOH
D.HNO3
(3)耐蚀铝材因为其表面形成坚硬的????????(填化学式),这种物质有时候也可以用来作耐火材料,是因为????????????
参考答案:本题解析:
答案:⑴2Al+2OH―+2H2O=2AlO2―+3H2↑;HCO3―+H+=CO2↑+H2O(2) B (3) Al2O3,氧化铝熔点高
解析:(1)碱洗的目的是除去铝材表面的自然氧化膜,碱洗时候常有气泡冒出,原因是铝也能与碱反应:2Al+2OH―+2H2O=2AlO2―+3H2↑;废电解液中有过量的酸,往废电解液中加入NaHCO3时会出现气泡,原因是;HCO3―+H+=CO2↑+H2O(2)槽液中有AlO2―,AlO2―+2H2O+CO2=Al(OH)3+HCO3―,选 B;(3)耐蚀铝
本题难度:一般
3、填空题 海水占地球总储水量的97.2%,若把海水淡化和化工生产结合起来,既可解决淡水资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中的金属元素位于元素周期表的________族。
(2)目前,国际上使用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸气,蒸气经冷却而得高纯度的淡水。由此可判断蒸馏法是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品。反应式为:
NaCl+H2O NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
NaOH+H2↑+Cl2↑(未配平),该反应中NaCl的电子式是______;利用电解所得气体制36.5%的浓盐酸1000 t,最少需消耗食盐______t。(可能用到的相对原子质量:Na:23,Cl:35.5,H:1,O:16)
(4)近年来,有人提出了一种利用氯碱工业产品及氯化钠循环治理含二氧化硫废气并回收二氧化硫的方法。该方法流程如下图: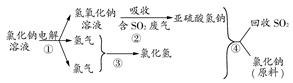
请写出②④的化学反应方程式:________、________。
参考答案:(1)ⅠA
(2)物理变化
(3)
本题解析:(1)氯化钠中的金属元素为钠,它应位于元素周期表的ⅠA族。
(2)将海水蒸馏变成水蒸气属于物理变化。
(3)NaCl的电子式为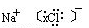 ,要制36.5%的浓盐酸1000 t所消耗的食盐应为
,要制36.5%的浓盐酸1000 t所消耗的食盐应为本题难度:一般
4、选择题 下列叙述正确的是[???? ]
A.通过沉淀反应,可以使溶液中被沉淀离子的浓度为零
B.化学反应过程中,一定有化学键的断裂和形成
C.若测得雨水的pH小于7,则下的是酸雨
D.在通风橱中进行有毒气体实验符合“绿色化学”思想
参考答案:B
本题解析:
本题难度:简单
5、填空题 (本题共12分)
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的流程如下: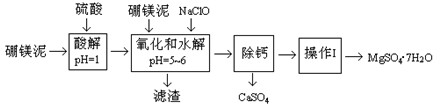
根据题意回答:
1.实验中需用0.8mol/L的硫酸800 mL,若用98%的浓硫酸(ρ=" 1.84" g/mL)来配制,量取浓硫酸时,需使用的量筒的规格为???????
A.10 mL
B.20 mL
C.50 mL
D.100 mL
2.加入的NaClO可与Mn2+反应:Mn2+ + ClO- + H2O → MnO2↓ + 2H+ + Cl-,还有一种离子也会被NaClO氧化,该反应的离子方程式为??????????????????????????????????。
3.滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有????????????????????????????。
4.在“除钙”前,需检验滤液中Fe3+是否被除尽,简述检验方法???????????????????。
5.已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 “除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤????????????????????????????????????。“操作I”是将滤液继续蒸发浓缩,冷却结晶,??????????,便得到了MgSO4·7H2O。 6.实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为172.2 g,则MgSO4·7H2O的产率为???????。 参考答案:(共12分) 本题解析:1根据容量瓶的规格需要配制1L的硫酸溶液;设所需浓硫酸的体积为V ml 本题难度:一般 |