时间:2017-01-19 02:00:04
1、选择题 某学生在课堂上学到了卤素、电解等化学知识后,想为自己家中制作一只简易的消毒液发生器。他用石墨(废干电池中的炭棒)作电极,饱和氯化钠溶液作为电解液,制成了如图所示的装置。通电数分钟后,果真制得了消毒液。他的实验居然一举获得成功!该装置中电源电极的名称和消毒液的主要成分正确的是....…………..(?? )
A.a为正极,b为负极;NaClO和NaCl
B.a为负极,b为正极;NaClO和NaCl
C.a为阳极,b为阴极;HClO和NaCl
D.a为阴极,b为阳极;HClO和NaCl
参考答案:B
本题解析:
试题分析:惰性电极电解饱和食盐水生成物是氯气、氢气和氢氧化钠,则要制备消毒液,就必须使生成的Cl2被完全吸收,由此可知应该在装置的下端电极上生成Cl2,即溶液中的Cl-被氧化成Cl2,发生氧化反应,该电极为电解池的阳极,与之相连的电源b极为正极,答案选B。
点评:该题是高考中的常见题型,属于中等难度的试题。试题基础性强,侧重大于学生解题能力和方法的培养与训练,有利于培养学生的逻辑推理能力。该题的关键是明确电解的工作原理,并能结合题意灵活运用即可,有助于调动学生的学习兴趣。
本题难度:简单
2、填空题 (16分)MnO2是重要化学物质,某学习小组设计了将粗MnO2(含有较多的MnO、MnCO3和Fe2O3)样品转化为纯MnO2实验,其流程如下: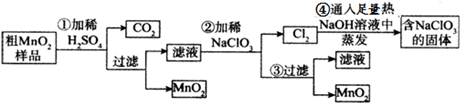
按要求回答下列问题
(1) 第②步操作中,氧化性强弱顺序:ClO3-______ MnO2 (填“>”“<”),当NaClO3转移2mol电子时,生成的氧化产物的物质的量为________mol。NaClO3在常温下能够与盐酸反应生成氯气,该反应的离子方程式为___________________。
(2)第④步操作中,最终得到的固体除NaClO3外,还一定含有下列物质中的_________
a.NaCl b.NaClO c.NaClO4 d.NaOH
(3)MnO2是碱性锌锰电池的正极材料,则碱性锌锰电池放电时,正极的电极反应式是:__________。
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,判断是否洗涤干净可选用的试剂是______(填写一组即可)。工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,该反应的阳极反应式为_____________。
参考答案:(1)>,1,ClO3-+5Cl-+6H+=3Cl2↑+3H
本题解析:
试题分析:(1)第②步操作中,发生的反应为5MnSO4+2NaClO3+4H2O=5MnO2+Cl2↑+Na2SO4+4H2SO4,由方程式可知,ClO3-的氧化性大于MnO2;
(2)氯气通入足量氢氧化钠溶液中,发生了氧化还原反应,产物为NaCl及过量的氢氧化钠;故选择ad;
(3)在碱性锌锰干电池中,MnO2为电池的正极,电极反应为MnO2+2H2O+2e-=Mn(OH)2+2OH-;
(4)为得到纯净的MnO2,须将过滤后的MnO2合并后进行洗涤,加入氯化钡溶液,用于检验硫酸根离子,也可加入硫氰化钾溶液,检验三价铁离子;工业上可以以石墨为电极电解酸化的硫酸锰制取二氧化锰,硫酸锰做阳极,电极反应为Mn2+-2e-+2H2O=MnO2+4H+。
考点:氧化还原反应,电解池电极反应的书写
本题难度:困难
3、填空题 如图为相互串联的甲乙两电解池
试回答:
(1)甲池若为用电解原理精炼铜的装置,则A是 极,材料是 ,
电极反应为 。
(2)乙池中若滴入少量酚酞试液,电解一段时间后Fe极附近呈 色.
(3)若甲池为电解精炼铜,阴极增重12.8g,则:乙池中阳极放出的气体在标准状况下的体积为
;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 。
参考答案:1)阴极;纯铜;Cu2++2 e- =" Cu" ;(2)红
本题解析:
试题分析:结合装置图,与电源负极相连的是阴极,与电源正极相连的是阳极,甲池若为用电解原理精炼铜的装置,则A是阴极,材料为纯铜,发生电极反应是Cu2++2 e- = Cu。
乙池中实质是电解NaCl饱和溶液,C极上放出Cl2,Fe极上生成H2 ,2H2O+2e-=H2↑+2OH,若滴入少量酚酞试液,电解一段时间后Fe极附近呈红色。若甲池为电解精炼铜,阴极增重12.8g,即转移的电子有 ,则乙池中阳极放出的气体在标准状况下的体积为
,则乙池中阳极放出的气体在标准状况下的体积为 ;产生OH-有0.4mol,若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为
;产生OH-有0.4mol,若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 。
。
考点:电解池
点评:考查电解池实验装置图,难度不大,解题的关键是要区分正负极,电极发生的反应,把握得失电子情况,仔细计算。
本题难度:一般
4、选择题 早在1807年化学家戴维用电解熔融氢氧化钠制得钠:4NaOH(熔融)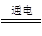 ?4Na+O2↑+2H2O;后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH ?
?4Na+O2↑+2H2O;后来吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为3Fe+4NaOH ?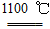 Fe3O4+2H2↑+4Na↑。下列有关说法正确的是???????????? ( )
Fe3O4+2H2↑+4Na↑。下列有关说法正确的是???????????? ( )
A.电解熔融氢氧化钠制钠,阳极发生的电极反应为2OH--2e-=H2↑+O2↑
B.若用戴维法与吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
C.吕萨克法制钠的原理是利用铁的还原性比钠强
D.目前工业上常用电解熔融氯化钠法制钠(如下图),电解槽中石墨为阳极,铁为阴极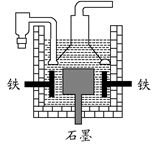
参考答案:D
本题解析:电解熔融氢氧化钠制钠,阳极发生的电极反应为4OH--4e-=O2↑+2H2O,A项错误;戴维法制备钠,只有钠是还原产物,而吕萨克法制备钠时,还原产物除钠外,还有氢气,故制备等量钠时,两反应中转移的电子总数不同,B项错误;铁的还原性比钠弱,吕萨克法制钠利用的是化学平衡原理,产物中气态钠及时抽走,使平衡右移,C项错误。
本题难度:一般
5、选择题 按如图所示装置进行下列不同的操作,说法不正确
的是????????????????????????????????(???)
A.铁腐蚀的速度由大到小的顺序是:只接通K1>只
闭合K3>都断开>只闭合K2
B.只接通K1,一段时间后,U形管中出现白色沉淀
C.只接通K2,U形管左、右两端液面均下降
D.先只接通K1,一段时间后,漏斗液面上升,然后再
只接通K2,漏斗液面下降
参考答案:D
本题解析:只闭合K1,铁做阳极电解氯化钠溶液,铁失电子生成二价铁离子,氢离子在阴极得电子生成氢气和氢氧根离子,二者扩散到U形管底部相遇生成白色氢氧化亚铁沉淀,B项正确;只接通K2,铁做阴极,不能失电子,此时相当于惰性电极,该极生成氢气,石墨电极生成氯气,C项正确;综上分析只接通K1铁腐蚀最快,只闭合K3,形成原电池,铁腐蚀的速率次之,都断开时铁自然腐蚀,而只接通K2时为铁做阴极被保护,腐蚀速率最慢,A项正确。
本题难度:一般