得到FeSO?4溶液
(3)若向CuSO4、FeSO4混合液中加入适量碱液,将溶液蒸干、灼烧得到红色粉末是Fe2O3、Cu2O混合物,欲测定该混合物中Cu2O的质量分数。该实验小组的方法是向m g混合物中加人足量的稀硫酸,经过滤、洗涤、干燥、称量固体的质量为n g。已知Cu2O溶于稀硫酸生成Cu和CuSO4。某学生据此计算出该混合物Cu2O的质量分数的计算式 。该学生的计算是否正确:???????????????,请说明理由???????????????????????????????????????????????????????????????。 。该学生的计算是否正确:???????????????,请说明理由???????????????????????????????????????????????????????????????。
参考答案:(14分)1、4FeSO4+2H2SO4+O2=2Fe2(S
本题解析:(1)根据反应物和生成物可知,该反应的方程式是4FeSO4+2H2SO4+O2 2Fe2(SO4)3+2H2O 2Fe2(SO4)3+2H2O
(2)pH>3.7时,Fe(OH)3已沉淀完全,而pH=6.0时Cu(OH)2才开始沉淀,则可以通过调节溶液的pH使铁元素、铜元素分离。分离时,首先将Fe2+氧化为Fe3+,氧化剂选择H2O
本题难度:一般
2、填空题 为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。主要反应如①②③:
① 3Fe+NaNO2+5NaOH = 3Na2FeO2+NH3+H2O
② ___Na2FeO2+____NaNO2+____H2O = ????N a2Fe2O4+????NH3+????NaOH a2Fe2O4+????NH3+????NaOH
③ Na2FeO2+Na2Fe2O4+2H2O  ?Fe3O4+4NaOH ?Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应②中还原剂为??????????????,被还原物质是????????? 。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。 。若有1mol Na2Fe2O4生成,则反应中有____________mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是:???????????????。
参考答案:
 本题解析:略 本题解析:略
本题难度:一般
3、选择题 某溶液中,滴入KSCN溶液时无明显现象,再滴入少量新制氯水,溶液立即变为血红色,则原溶液中一定含有的离子是( )
A.Fe2+
B.Fe3+
C.Al3+
D.Cu2+
参考答案:A
本题解析:该操作方法为溶液中Fe2+ 的操作方法,利用Fe2+ 的还原性及氯水的强氧化性;生成的、Fe3+ 离子与KSCN反应生成Fe(SCN)3,使溶液呈血红色。
本题难度:简单
4、选择题 下列物质能将Fe3+转化为Fe2+的有(????)
①新制氯水??②铁???③铜??④稀硫酸
A.①②③
B.③④
C.②③
D.①②③④
参考答案:C
本题解析:
试题分析:将三价铁转化为二价铁应选择还原剂铁或铜。
点评:新制氯水有氧化性,能将Fe2+氧化为Fe3+;Fe3+转化为Fe2+可用还原剂S2-、I-、H2S、SO2、SO32-、Zn、Cu、Fe等。
本题难度:一般
5、选择题 Cu和Cu2O的混合物7.6 g与足量稀硝酸反应,产生NO气体在标准状况下体积为1.12 L,向所得溶液中加入足量的NaOH溶液,产生的沉淀经过滤、洗涤、干燥、灼烧后,得到黑色固体的质量是
A.8.8 g
B.9.2g
C.8 g
D.16 g
参考答案:A
本题解析:标准状况下体积为1.12 LNO气体的物质的量为0.05mol;反应过程中转移电子的物质的量为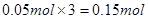 ;设铜的物质的量为x,氧化亚铜的物质的量为y;所以得 ;设铜的物质的量为x,氧化亚铜的物质的量为y;所以得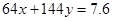 本题难度:简单 本题难度:简单
|