时间:2017-01-19 01:40:10
1、选择题 下列叙述不正确的是( )。
A.向Mg(OH)2悬浊液中加少量NH4Cl固体,溶液变澄清
B.向AgI在水中的平衡体系中加入Na2S溶液沉淀会转化为黑色
C.用水洗涤BaSO4比用稀硫酸洗涤损失的沉淀要少
D.MgCO3在水中加热可以转化为Mg(OH)2
参考答案:C
本题解析:稀硫酸中SO42-浓度大,可以降低硫酸钡的溶解,所以选项C是错误的,其余都是正确的,答案选C。
本题难度:简单
2、选择题 已知25℃时,电离常数Ka(HF)=3.6×10-4 mol·L-1,溶度积常数KSP(CaF2)=1.46×10-10 mol3·L-3。现向1L 0.2 mol·L-1HF溶液中加入1L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是??????????????????????????????????????????????????????????????????[???? ]
A.25℃时,0.1 mol·L-1HF溶液中pH=1
B.该体系中有CaF2沉淀产生
C.该体系中KSP(CaF2)=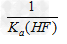 ?
?
D.KSP(CaF2)随温度和浓度的变化而变化
参考答案:B
本题解析:
本题难度:一般
3、填空题 (8分)某温度下的水溶液中,c(H+)=10-xmol/L,c(OH-)=10-y mol/L。x与y的关系如图所示: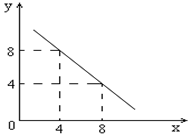
(1)该温度下水的离子积为????????(填具体数值);该温度???????常温(填“高于”、“低于”或“等于”)。
(2)该温度下0.01 mol/L NaOH溶液的pH为 。
(3)除了用pH外,科学家还建议用酸度(AG)来表示溶液的酸碱性: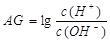 。则该温度下,0.01mol/L盐酸的酸度AG=?????????。
。则该温度下,0.01mol/L盐酸的酸度AG=?????????。
参考答案:(1)10-12????高于?????(2)10??????
本题解析:(1)根据图像可x=4时,y=8,所以该温度下水的离子积常数是10-4·10-8=10-12>10-14,所以温度高于常温。
(2)0.01 mol/L NaOH溶液中OH-的浓度是0.01 mol/L,所以氢离子的浓度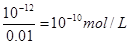
,因此pH=10。
(3)0.01mol/L盐酸溶液中氢离子浓度是0.0
本题难度:简单
4、填空题 (1)Mg(OH)2在下列四种情况下,其溶解度大小关系为_______________。
A.在纯水中? B.在0.1 mol ·L-1的MgCl2溶液中 C.在0.1 mol ·L-1的CH3COOH溶液中
(2)向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
参考答案:C>A>B
本题解析:
⑴C>A>B,B中Mg2+浓度高,抑制Mg(OH)2溶解;C、酸性,促进Mg(OH)2溶解;
⑵AgCl > AgI > Ag2S,溶解度大的转化为溶解度小的。
本题难度:简单
5、填空题 (10分)请根据所学化学知识回答下列问题:
(1)氯化铁溶液蒸干并灼烧后得到的固体物质的化学式是________。
(2)在浓度均为0.1 mol/L的①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4四种溶液中,NH4+浓度由大到小的顺序为________(用代号表示)。
(3)25时,某浓度的CH3COONa溶液呈碱性的原因是________(用离子方程式表示),溶液中所有离子的浓度由大到小的顺序是________。
(4)某温度下,蒸馏水的pH = 6,氢氧化物R(OH)2的Ksp = 1×10-13,则R2+沉淀完全时,溶液的pH为_______。
参考答案:(1) Fe2O3 (2
本题解析:
试题分析:(1)加入氯化铁溶液,会促进水解,HCl不断挥发,导致最终得到Fe(OH)3,灼烧后得Fe2O3 ,(2)比较离子的浓度大小,分析物质的组成,且盐类的水解程度微弱,所以NH4+的离子浓度最大的是④,①中发生双水解,离子浓度最小,②中H+抑制水解,③电离程度小,所以离子浓度最小。(4)由已知条件确定该温度下水的离子积为10-12,当则R2+沉淀完全时,离子浓度小于10-5,结合物R(OH)2的Ksp = 1×10-13,c(OH-)=10-4mol/L,c(H+)=Kw/c(OH-)=10-8mol/L,所以pH为8.
考点:盐类的水解、离子浓度的大小比较、溶度积的计算。
本题难度:一般