时间:2017-01-19 01:21:51
1、选择题 已知三角锥形分子E和直线形分子G反应,生成两种直线形分子L和M(组成E、G、L、M分子的元素原子序数均小于10),如下图,下列判断错误的是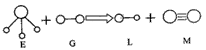 [???? ]
[???? ]
A.G是最活泼的非金属单质
B.L能使紫色石蕊试液变红色
C.E能使紫色石蕊试液变蓝色
D.M是化学性质很活泼的单质
2、填空题 I、卤素化学丰富多彩,能形成卤化物、卤素互化物、多卤化物等多种类型的化合物.
(1)①HClO4、②HIO4、③H5IO6??的酸性由强到弱的顺序为______(填序号).
(2)卤素互化物如BrI、ICl等与卤素单质结构相似、性质相近.Cl2、BrI、ICl沸点由高到低的顺序为______.
(3)气态氟化氢中存在二聚分子(HF)2,这是由于______.
(4)I3+(可看成II2+)属于多卤素阳离子,根据VSEPR模型推测I3+的空间构型为______.
(5)卤化物RbICl2加热时会分解为晶格能相对较大的卤化物A和卤素互化物或卤素单质,A的化学式为______.
II.氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于?NH4+的性质.
(1)出N2H62+在足量碱性溶液中反应的离子方程式______.
(2)NH2-的电子式为______.
(3)写出两种由多个原子组成的含有与N3-电子数相同的物质的化学式______.
(4)等电子数的微粒往往具有相似的结构,试预测N3-的构型______.
(5)据报道,美国科学家1998年11月合成了一种名为“N5”的物质,由于其具有极强的爆炸性,又称为“盐粒炸弹”.迄今为止,人们对它的结构尚不清楚,只知道“N5”实际上是带正电荷的分子碎片,其结构是对称的,5个N排成V形.如果5个N结合后都达到8电子结构,且含有2个N≡N键.则“N5”分子碎片?所带电荷是______.
3、填空题 晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体结构如图所示。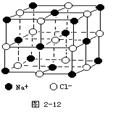
(1)晶体中每个Na+同时吸引着______个Cl-,
每个Cl-同时吸引着_______个Na+。
(2)晶体中在每个Cl-周围与它最接近且距离相等
的Cl-共有________个。
(3)在干冰晶体中每个CO2分子周围紧邻的 CO2分子有___________个,?在晶体中截取一个最小的正方形;使正方形的四个顶点部落到CO2分子的中心,则在这个正方形中有___________个C02分子。其中,C原子的杂化类型为??????。C02分子中碳氧之间有π键,而SiO2中硅氧之间无π键,原因是?????????????????????。
4、选择题 下面叙述所指的物质一定是金属单质的是(??? )
A.具有金属光泽并能导电的固体
B.晶体里有阳离子而没阴离子,具有延展性的固体
C.单质跟碱溶液反应有氢气生成的固体
D.具有显著还原性的固体
5、选择题 下列说法不正确的是
A.SO2中S原子含1对孤电子对
B.BeCl2是直线形分子
C.SO3的空间构型为平面三角形
D.H20的VSEPR构型和空间构型都是V形