1、填空题 下图是元素周期表的框架
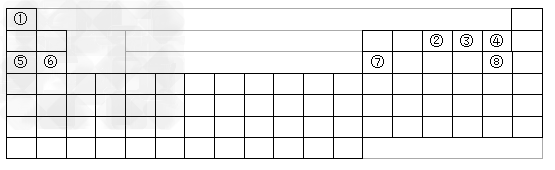
(1)请在上图中画出金属元素和非金属元素的分界线(线条必须明显)。
(2)依据上述元素周期表的框架中提供的信息回答下列问题(1、2、3用化学式表示):?????
1)⑤和⑥两种元素的最高价氧化物的水化物碱性强弱顺序是???????????????? ;
2)写出由①、③、⑧三种元素形成的最简单化合物的电子式?????????????????? ;
3)某元素的单质在常温下化学性质稳定,通常可作为化学反应保护气的是?????? ;
4)全部是金属元素的主族是???????? ,全部是非金属元素的主族是??????????。??
??????a. ⅠA族??????b. ⅡA族????????c. ⅣA族???????? d. ⅦA族
(3)某元素是第三周期的金属元素,且其原子半径是同周期的金属中最小的,则该元素的单质与NaOH溶液反应的离子方程式是??????????????????????????????。
参考答案:(1 )“略”
(2 ) 1 )NaOH >Mg(OH
本题解析:
本题难度:一般
2、选择题 下列有关物质性质、结构的表述均正确,且存在因果关系的是[???? ]
表述I?
表述Ⅱ
A.
?? 在水中,NaCl的溶解度比I2的溶解度大
NaCl晶体中Cl-与Na+间的作用力
大于碘晶体中分子间的作用力
B.
?? 通常条件下,CH4分子比PbH4分子稳定性高
Pb的原子半径比C的大,Pb与H
之间的键能比C与H 间的小
C.
?? 在形成化合物时,同一主族元素的化合价相同
同一主族元素的原子最外层电子数相同
D.
?? P4O10、C6H12O6溶于二水后均不导电
P4O10、C6H12O6均属于共价化合物
参考答案:B
本题解析:
本题难度:简单
3、填空题 掌握以下物质的电子式
N2( )NH3( )H2O( )H2O2( )
NaOH( )Na2O2( )HCl( )CH4( )
参考答案:“略”
本题解析:
本题难度:简单
4、填空题 铁、钴、镍为第四周期第Ⅷ族元素,它们的性质非常相似,也称为铁系元素。
(1)铁、钴、镍都是很好的配位化合物形成体。
①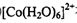 在过量氨水中易转化为
在过量氨水中易转化为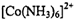 。写出
。写出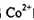 的价层电子排布图____。
的价层电子排布图____。
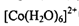 ?中
?中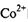 的配位数为____:NH3分子的中心原子杂化方式为____。
的配位数为____:NH3分子的中心原子杂化方式为____。
H2O分子的立体构型为__________。
②铁、镍易与一氧化碳作用形成羰基配合物,如: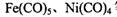 等。CO与N2属于等电子体,则CO分子中
等。CO与N2属于等电子体,则CO分子中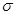 键和
键和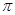 键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
键数目比为____,写出与CO互为等电子体的一种阴离子的离子符号____。
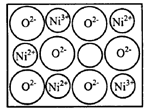
(2)+2价和+3价是Fe、Co、Ni等元素常见化合价。NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO____FeO(选填“<”“>”“=”); 某种天然Nio晶体存在如图所示缺陷:一个Niz+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈屯中性。某氧化镍样品组成为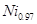 O.该晶体中Ni3+与Ni2+的离子数之比为____。
O.该晶体中Ni3+与Ni2+的离子数之比为____。
参考答案:(1)① 本题解析:
本题解析:
试题分析:(1)①铁、钴、镍三个元素的最外层都有两个电子,仅次外层d电子分别为6、7、8;可以根据分子的空间构型或键角来判断中心原子轨道的杂化方式:sp: 直线形 180°? sp2: 平面三角形 120°? sp3: 正四面体 109.5°②原子的最外层达到8电子时是比较稳定的,对于CO来说,碳原子最外层是4个电子,氧原子最外层是6个电子,要形成稳定的结构,碳和氧共用两对电子,氧原子再提供一对电子作为配位键,这样双方都达到了8电子的稳定结构,即CO中有一个σ键二个π键(2)离子半径越小,熔点越高
本题难度:一般
5、选择题 下列物质中,只含有共价健的是( ? )
A.CO2
B.NaCl
C.Na2O2
D.NaOH
参考答案:A
本题解析:
本题难度:一般
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
