时间:2017-01-19 01:10:45
1、实验题 某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空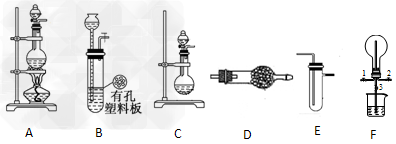
Ⅰ、探究氯气与?氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用_____。
a.碱石灰? b.氯化钙? c.五氧化二磷? d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是_________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3→N2+6HCl)的反应。实验时打开开关1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现?浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子___________________。
Ⅱ、探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是 __________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,必须对装置A进行的改动是______。
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。请设计实验检验反应后F的烧瓶中可能剩余气体的成分。
__________________________
2、实验题 根据氨气还原氧化铜的反应,可设计测定铜元素相对原子质量Ar(Cu)(近似值)的实验。先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar (Cu)。为此,提供的实验仪器及试剂如下(根据需要可重复选用,加入的NH4Cl与Ca(OH)2的量足以产生使CuO完全还原的氨气): 
请回答下列问题:
(1)氨气还原炽热氧化铜的化学方程式为____________________________;
(2)从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的导管口符号表示)a→__________________;
(3)在本实验中,若测得m(CuO)= a g,m(H2O)= b g,则Ar(Cu)= _______________;
(4)在本实验中,使测定结果Ar(Cu)偏大的是_______________ (填序号);
①CuO未完全起反应
② CuO不干燥
③CuO中混有不反应的杂质
④ 碱石灰不干燥
⑤NH4C1与Ca(OH)2混合物不干燥
(5)在本实验中,还可通过测定______和_____,或_____和______达到实验目的。
3、实验题 (9分)、已知FeSO4在不同条件下分解得到的产物不同,可能是FeO和SO3,也可能是Fe2O3、SO3和SO2。某研究小组探究在酒精喷灯加热条件下FeSO4分解的气体产物。已知SO3的熔点是16.8℃,沸点是44.8℃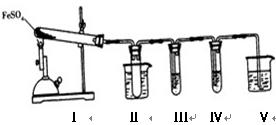
⑴装置Ⅱ的试管中不装任何试剂,其作用是??????????????????????。试管浸泡在50℃的水浴中,目的是???????????????????????????????????????。
| 检验试剂 | 预期现象与结论 |
| 装置Ⅲ的试管中加入?????????????????。 | 产生大量白色沉淀,证明气体产物中含有SO3 |
| 装置Ⅳ的试管中加入??????????????????。 | ??????????????????????????????????????????? ???????????  ????????????????????????????????? ?????????????????????????????????⑵装置Ⅲ和装置  Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。限选试剂:3mol·L-1H2SO4、6 mol·L-1NaOH、0.5 mol·L-1BaCl2、0.5 mol· Ⅳ的作用是探究本实验气体产物成分。请完成实验设计,填写检验试剂、预期现象与结论。限选试剂:3mol·L-1H2SO4、6 mol·L-1NaOH、0.5 mol·L-1BaCl2、0.5 mol· L-1Ba(NO3)2、0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水 L-1Ba(NO3)2、0.01 mol·L-1酸性KMnO4溶液、0.01 mol·L-1溴水⑶装置Ⅴ的作用是防止尾气污染环境,烧杯中应加入的试剂是???????????。 4、实验题 (12分)同学们课外探究酸的性质活动中将以下8个实验分为三组进行(如下图所示)。 5、选择题 下列装置合理,且能达到实验目的的是 |