时间:2017-01-19 01:02:36
1、填空题 已知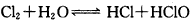 ,为了探究HClO的漂白性,同学设计的如下图的实验:
,为了探究HClO的漂白性,同学设计的如下图的实验: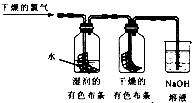
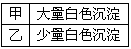
(1)通入干燥的氯气后,集气瓶中湿润的有色布条很快褪色,而干燥的有色布条没有褪色,因此甲同学得 出结论:______________________。
(2)细心的乙同学发现,一段时间后干燥的有色布条也褪色了,他经过仔细思考,认为甲的设计有缺陷, 应该作如下修改:_________________。
(3)丙同学按照乙同学的方案修改后,补做了盐酸加入到有色布条,发现有色布条不褪色,丙同学确认是 HClO使湿润的有色布条褪色,但丁同学认为还是不能确认HClO使湿润的有色布条褪色,他认为还应增加的实验是:_______________________。
参考答案:(1)干燥的氯气没有漂白性,潮湿的氯气有漂白性
(2
本题解析:
本题难度:一般
2、实验题 甲、乙两同学为探究SO2与可溶性钡的强酸盐能否反应生成白色BaSO3沉淀,用下图所示装置进行实验(夹持装置和A中加热装置已略,气密性已检验)。 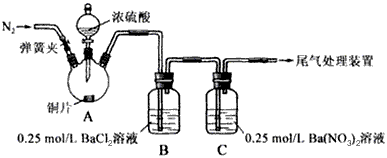
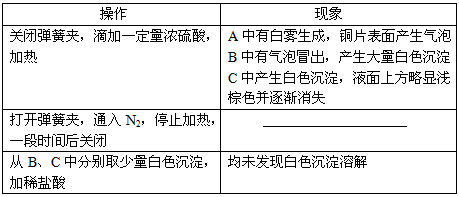
参考答案:⑴Cu+2H2SO4本题解析:
本题难度:困难
3、填空题 (8分)某校化学兴趣小组对附近一化工厂排出的污水进行监测。发现污水中含某些金属离子对水质和环境造成了严重污染。他们曾对该厂排出的污水取样、过滤,对滤液进行了多次检测,其中有三次检测结果发现有如下物质:①CuCl2、FeCl3、MgSO4、H2SO4;②CuSO4、 MgCl2、Fe2 (SO4)3、HCl;③CuSO4、AgNO3、FeCl3、HCl。试回答:
(1)三次检测的结果中第________次检测的结果不正确。
(2)研究小组根据检测结果,向化工厂提出建议:用一种含钠离子的化合物来处理污水,就可以同时除去检测出的金属离子。这种化合物是_____________。
(3)在检测时,为了确定滤液中是否存在硫酸根离子和氯离子,同学们将滤液酸化后,首先向滤液中加入过量的_____________溶液,将反 应后的混合物过滤,再向得到的滤液中加入_____________溶液。
应后的混合物过滤,再向得到的滤液中加入_____________溶液。
参考答案:(1)③(2)NaOH(3)Ba(NO3)2??AgNO3
本题解析:略
本题难度:简单
4、实验题 某校化学研究性学习小组查阅资料了解到以下内容:乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸,其熔点为101.5℃,在157℃升华。为探究草酸的部分化学性质,进行了如下实验:
(1)向盛有1 mL饱和NaHCO3溶液的试管中加入足量乙二酸溶液,观察到有无色气泡产生。该反应的离子方程式为____________________________;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去;①说明乙二酸具有_____________(填“氧化性”、“还原性”或“酸性”);
②请配平该反应的离子方程式: ____ MnO4- + ___ H2C2O4 + ____ H+ = ____ Mn2+ + ___ CO2↑ + ____H2O
(3)将一定量的乙二酸放于试管中,按下图所示装置进行实验(夹持装置未标出): 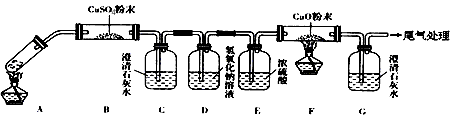
实验发现:装置C、G中澄清石灰水变浑浊,B中CuSO4粉末变蓝,F中CuO粉末变红。据此回答:
①上述装置中,D的作用是__________________,②乙二酸分解的化学方程式为_____________________________________;
(4)该小组同学将2.52 g草酸晶体(H2C2O4·2H2O)加入到100 mL 0.2 mol/L的NaOH溶液中充分反应,测得反应后溶液呈酸性,其原因是___________________________________(用文字简单表述),该溶液中各离子的浓度由大到小的顺序为:___________________(用离子符号表示)。
参考答案:(1)HCO3- + H2C2O4 = HC2O4-+ CO
本题解析:
本题难度:一般
5、填空题 10分)某化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验
取适量牙膏样品,加水成分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是__________________________????? ___?????????????????? ______。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是______________________????????????????????????___???????? ______。
Ⅱ.牙膏样品中碳酸钙的定量测定
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。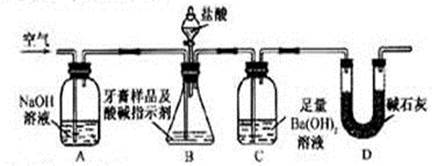
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有:____________________?????????????????????????????????????????_____________。
(4)C中反应生成BaCO3的化学方程式是_______________________ _________。
(5)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为_________。
参考答案:(1)Al(OH)3+OH-=[Al(OH)4]-或Al(O
本题解析:(1)氢氧化铝为典型的两性氢氧化物,与强碱反应的离子方程式为:
Al(OH)3 +OH-=AlO2-+2H2O
(2)通入CO2气体有白色沉淀生成;加入盐酸有气体生成、沉淀溶解,反应的离子方程式为:2CO2+ALO2-+H2O=AL(OH)3↓+2HCO3-;AL(OH)3+3H+=AL3++3H2O;
(3)把生成的CO2气体全部排入C中,使之完全被Ba(OH)2溶液吸收,提高实验的准确性
(4)二氧化碳与氢氧化钡反应的离子方程式为:CO2+Ba(OH)2=BaCO3↓+H2O
(5)BaCO3平均质量为3.94g,即物质的量为0.02 mol;由C元素守恒可得碳酸钙的物质的量为0.02 mol,质量为2 g,从而求得样品中碳酸钙的质量分数为25%
本题难度:一般