时间:2017-01-19 00:58:40
1、选择题 铜锌原电池(如图)工作时,下列叙述正确的是( )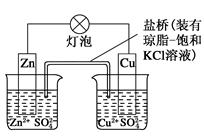
A.正极反应为Zn-2e-=Zn2+
B.电池反应为Zn+Cu2+=Zn2++Cu
C.在外电路中,电子从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
参考答案:BC
本题解析:Zn是负极,故A项错误;电池总反应和没有形成原电池时的氧化还原反应相同,故B项正确;根据闭合回路的电流方向,在外电路中,电子由负极流向正极,故C项正确;在溶液中,阳离子向正极移动,故D项错误。
本题难度:一般
2、选择题 如图所示,a、b是多孔石墨电极,某同学按图示装置进行如下实验:断开Kv,闭合Ke一段时间,观察到两只玻璃管内都有气泡将电极包围,此时断开Ke,闭合Kv,观察到电流计A的指针有偏转.下列说法不正确的是( )
A.断开K2,闭合K1一段时间,溶液的pH要变大
B.断开K1,闭合K2时,b极上的电极反应式为:2H++2e-═H2
C.断开K2,闭合K1时,a极上的电极反应式为:4OH--4e-═O2↑十2H2O
D.断开K1,闭合K2时,OH-向b极移动
参考答案:A、断开K3,闭合K1时,相当于电解装置,相当于电解氢氧化钾
本题解析:
本题难度:一般
3、选择题 一种新型熔融盐燃料电池具有高发电效率.现用Li2CO3和Na2CO3的熔融盐混合物作电解质,一极通CO气体,另一极通O2和CO2混合气体,其总反应为:2CO+O2==2CO2.则下列说法中正确的是[???? ]
A.通CO的一极是电池的正极
B.负极发生的电极反应是:O2+2CO2+4e-===2CO32-
C.负极发生的电极反应是:CO+CO32--2e-===2CO2
D.正极发生氧化反应
参考答案:C
本题解析:
本题难度:一般
4、填空题 (10分)科学家预言,燃料电池将是2l世纪获得电力的重要途径。一种甲醇燃料电池是采用铂或炭化钨作电极,在硫酸电解液中直接加入净化后的甲醇。同时向一个电极通入空气。
回答如下问题:
(1)配平电池放电时发生的化学反应方程式:
□CH3OH+□O2→□CO2+□H2O
(2)在硫酸电解液中,CH3OH(C为-2)失去电子。此电池的正极发生的反应是 ,负极发生的反应是 。
(3)电解液中的H+向???????极移动;向外电路释放电子的电极是???????。
(4)比起直接燃烧燃料产生电力,使用燃料电池有许多优点,其主要有两点:首先燃料电池的能量转化效率高,其次是 。
(5)甲醇燃料电池与氢氧燃料电池相比.其主要缺点是甲醇燃料电池的输出功率较低.但其主要优点是 。
参考答案:(1)2?? 3?? 2?? 4?? (2)O2+4H++4
本题解析:(1)甲醇中碳原子是-2价的,氧化产物中碳原子是+4价的,所以1mol甲醇失去6mol电子,而1mol氧气只能得到4mol电子,所以氧化剂和还原剂的物质的量之比是3︰2,所以方程式为2CH3OH+3O2=2CO2+4H2O.
(2)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以氧气再正极通入,甲醇再负极通入。由于是酸性溶液,所以电极反应式分别为)O2+4H++4e-===2H2O、CH3O
本题难度:一般
5、选择题 将锌片和铜片用导线连接置于同一稀硫酸溶液中,下列各叙述正确的是?
A.正极附近SO42-的浓度逐渐增大
B.负极附近SO42-的浓度逐渐减小
C.负极附近SO42-的浓度逐渐增大
D.正负极附近SO42-的浓度基本不变
参考答案:B
本题解析:略
本题难度:简单