时间:2017-01-19 00:41:21
1、选择题 (2009·重庆理综)物质的量浓度相同的下列溶液,pH由大到小排列正确的是( )
A.Ba(OH)2、Na2SO3、FeCl3、KCl
B.Na2SiO3、Na2CO3、KNO3、NH4Cl
C.NH3·H2O、H3PO4、Na2SO4、H2SO4
D.NaHCO3、C6H5COOH、C2H5OH、HCl
2、选择题 下列属于未来新能源的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④
B.⑤⑥⑦⑧
C.③⑤⑥⑦⑧
D.③④⑤⑥⑦⑧
3、填空题 酸是化学中重要的一类物质,人们对酸的认识是逐步加深的。
⑴ 1887年,阿仑尼乌斯提出了电离理论,在水溶液中能电离出H+的为酸,电离出OH?离子的为碱。比较水溶液中,下列阴离子的共扼酸的酸性大小_____________________(填序号)
⑵ 1905年,弗兰克提出了溶剂酸碱理论。该理论认为凡是在溶剂中产生该溶剂的特征阳离子的溶质叫酸,产生该溶剂的特征阴离子的溶质叫碱。试判断液NH3中加入Li3N后酸碱性变化情况,并结合方程式解释
⑶ 1923年布朗斯特提出了质子理论。认为凡是能够给出质子的物质都为酸,接受质子的物质为碱。有电子总数相同的三种微粒,它们既是质子酸又是质子碱,且分别为阴离子、中性分子和阳离子,它们是__________________________
⑷ 质子理论提出的同年,路易斯提出了电子理论,凡是接受电子对的为酸,给出电子对的为碱。NH3和NF3的均为路易斯碱, 碱性更强的是_____???????__ ,
理由是____________?????????????????????????????????????????_______
⑸ 1966年第一个超强酸被偶然发现,通常由质子酸和路易斯酸混合。用SbF5与氟磺酸反应后,可得到一种超强酸H[SbF5(OSO2F)]。写出该超强酸在氟磺酸中的电离方程式。
4、填空题 (9分)(1)已知25℃、101kPa时,一些物质的燃烧热为:
| 化学式 | CO(g) | H2(g) | CH3OH(l) |
| ΔH/( kJ·mol-1) | -283.0 | -285.8 | -726.5 请回答下列问题:①该条件下CH3OH(l)完全燃烧的热化学方程式为:__________________________。 ②根据盖斯定律完成下列反应的热化学方程式:CO(g)+2H2(g)===CH3OH(l)ΔH=____________。 (2)甲醇质子交换膜燃料电池中将甲醇蒸汽转化为氢气的两种反应原理是: ① CH3OH(g)+H2O(g)=CO2(g)+3H2(g)?△H1="+49.0" kJ·mol-1 ② CH3OH(g)+ 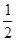 O2(g)= CO2(g)+2H2(g)?△H2 O2(g)= CO2(g)+2H2(g)?△H2已知H2(g)+ 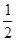 O2(g)===H2O(g)??△H =" -241.8" kJ·mol-1 O2(g)===H2O(g)??△H =" -241.8" kJ·mol-1则反应②的△H2= ?????????????kJ·mol-1。 (3)甲醇燃料电池的结构示意图如下。甲醇进入???????极(填“正”或“负”),正极发生的电极反应为??????????????????。  5、选择题 从环境保护角度分析,人类最理想的能源是 |