时间:2017-01-19 00:15:22
1、简答题 实验室合成乙酸乙酯粗产品的简易装置如右,由该实验可以得到乙酸乙酯粗产品.据此填空:
(1)反应中浓硫酸的作用是______
(2)实验结束时可用______(填仪器名称)将乙酸乙酯与饱和碳酸钠溶液分离
(3)如果以乙烯为原料,写出合成中发生反应的化学方程式及反应类型:______.
2、实验题 I、摩尔盐制备:将绿矾(FeSO4·7H2O)硫酸铵以相等物质的量混合可制得摩尔盐晶体。根据下图回答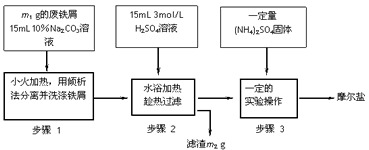
(1)步骤1中Na2CO3的主要作用是____________________。
(2)步骤3中,加入(NH4)2SO4固体后,要得到摩尔盐晶体,需经过的实验操作包括:加热蒸发、
__________、____________。
(3)步骤3中:加热是为了蒸发溶剂,浓缩结晶,应加热到___________时,停止加热。不能蒸干的原因是______________________。
II、产品中Fe2+的定量分析
将称取KMnO4固体并溶于水配成0.2mol·L-1 250mL溶液。再称取8.0g的摩尔盐样品,溶于水,并加入适量稀硫酸。用0.2mol·L-1 KMnO4溶液滴定,当溶液中Fe2+全部被氧化时,消耗KMnO4溶液体积20.00Ml。 (4)配制250mLKMnO4溶液,所需的主要仪器除玻璃棒、量筒、烧杯、胶头滴管外,还需要的玻璃仪器有
_______________ 。
(5)本实验指示剂是____________(填字母)。
A.甲基橙 B.石蕊 C.酚酞 D.不需要
(6)在滴定的过程中,要注意:
①使滴定管内的标准KMnO4溶液滴入锥形瓶中;
②_____________________________________;
③眼睛注意观察锥形瓶中溶液颜色的变化和加入KMnO4溶液的速度;
④接近终点时应该减慢加入KMnO4溶液的速度。当____________,即达到滴定终点。
(7)写出该反应中Fe2+被氧化的离子方程式_____________________________,则该产品中Fe2+的质量分数为______________。
3、实验题 NaClO2用于棉、麻、粘胶纤维及织物的漂白。实验室制备NaClO2的装置如下图所示: 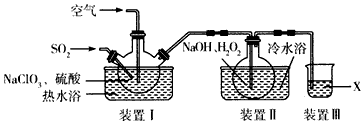
(1)装置I控制温度在35~55℃,通入SO2将NaClO3还原为ClO2(沸点:11℃),反应结束后通入适量的空气,其目的是____________________。
(2)装置Ⅱ中反应生成NaClO2的化学方程式为_______________。反应后的溶液中阴离子除了OH-外还可能含有的一种不含氯元素的阴离子是_______,检验该离子的方法是_______。
(3)已知在NaClO2饱和溶液中,温度低于38℃时析出的晶体是NaClO2·3H2O,温度高于38℃时析出的晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。请补充从装置Ⅱ反应后的溶液中获得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;②___________;③__________;④__________;⑤得到成品。
(4)装置Ⅲ中试剂X为______________。
4、实验题 课外活动小组甲,自行设计了下图装置进行乙醇的催化氧化实验并制取乙醛,图中铁架台等装置已略去。请回答下列问题:? 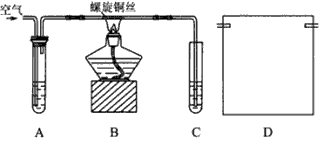
(1)实验前,首先检查装置的气密性,然后分别向试管A中加入乙醇,C中加入水;
(2)实验时,先加热B装置中的玻璃管,约1 min后鼓入空气,此时铜丝即呈红热状态。若把酒精灯撤走,控制一定的鼓气速率,铜丝能长时间保持红热直到实验结束。
①乙醇的催化氧化反应是____反应(填“放热”或“吸热”),该反应的化学方程式为____;
②通入空气的速度过快或过慢都不利于反应的进行,控制气体流速的实验操作现象是____;
课外活动小组乙,在研究了课外活动小组甲的方案后,认为该方案中有不足和不安全的地方。
(3)课外活动小组乙对甲的方案提出改进意见:
①将甲装置浸在70℃~80℃的水浴中,目的是____;
②装置B、C之间接上D装置,请你在上面方框中,画出D的装置图_________。
5、实验题 I 化学兴趣小组对用铜制取硫酸铜晶体的试验方案作研究。甲组同学将铜粉投入盛有稀硫酸的容器中,不发生反应。他们向容器底部缓缓鼓入氧气,溶液慢慢变蓝色,若在溶液中放置些铂丝,反应速率明显加快。此时,其他组的同学提出方案如下:
乙组:
丙组:
丁组:
戊组:
(1)甲组实验可用一个化学反应方程式表示为___________ ;使反应变快的可能原因是__________ ;从该反应器溶液(含有少量 以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。
以抑制水解)中取得产品的实验操作步骤应为_________ 、_______ 、__________ ,取得产品后的残留物质可循环使用。
(2)可持续发展的原则要求化工生产①原理科学;②能量消耗低;③原料利用率高;④无污染。则在五组方案中,__________ 组方案最好。
II.另一化学兴趣小组从化学手册上查得硫酸铜500℃在以上按照下式分解: ,便决定设计实验测定反应生成的
,便决定设计实验测定反应生成的 和O2的物质的量,并经计算确定该条件下
和O2的物质的量,并经计算确定该条件下 分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示:
分解反应方程式中各物质的化学计量数。试验可能用到的仪器如下图所示: 
试验测得数据及有关结果如下;
① 准确称取6.0g无水;
②在试验结束时干燥管总质量增加2.4g;
③测得量筒中水的体积,得出气体在标准状况下的体积为280.mL;
试验结束时,装置F中的溶液只含NaHSO4和NaHSO3按装置从左到右的方向,各仪器接口连结顺序为: ①⑨⑩⑥⑤③④⑧⑦②
试回答下列问题:
(3)装置F的作用是__________。
(4)装置D的作用是__________。
(5)为减少测量气体体积引起的误差,应注意的事项有:
①装置内气体的温度应恢复到室温。 ②_____________ , ③________________ 。
(6)通过计算,推断出该条件下反应的化学方程式_______________________。