2.28
回答如下问题:
(1) ?CuFeS2和O2主要反应的方程式为:
(2) ?实际生产过程的沸腾炉温度为 600~620℃。控制反应温度的方法是:
(3) ?温度高于600~620℃生成物中水溶性Cu (%)下降的原因是:
4、填空题 铁及其化合物在生活、生产中有着广泛的应用。
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂。某学习小组用下列流程测定铁触媒的含铁量。根据题意回答相关问题:
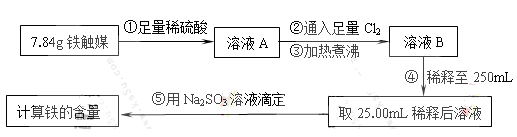
(1)步骤①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的浓硫酸来配制,则需要用量筒量取浓硫酸????????mL
(2)步骤②通入Cl2的目的是?????????????????(用离子方程式表示)
(3)步骤④后需用???????????(填仪器名称)取25.00mL稀释后溶液。
(4)步骤⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为?????????????。
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理。
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式?????????????????????,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的????????????作用。
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:
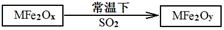
则可以判断x???????y,氧化性:MFe2Oy???????SO2(填“>”、“<”或“=”)
5、实验题 (12分)某氧化铁样品中含有少量的FeCl2杂质。现要测定其中铁元素的质量分数,按以下步骤进行实验:
请根据图的流程,回答下列问题:
⑴操作I的目的为配制250.00ml样品溶液,则所用到玻璃仪器除烧杯、玻璃棒、胶头滴管以外,还必须有????????(填仪器名称);操作II必须用到的仪器是????????????。(填字母)
A.50ml烧杯
B.50ml量筒
C.100ml量筒
D.25ml滴定管

⑵再加入氨水的离子方程式为???????????????????????????????。
⑶检验沉淀是否洗涤干净的操作是
????????????????????????????????????????????????????????????????。
⑷将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1—b2=0.3,则接下来还应进行的操作是?????????????。
⑸若坩埚的质量为W1g,坩埚与加热后固体的总质量为W2g,则样品中铁元素的质量分数是????????????????????。
⑹有学生认为上述实验步骤太繁琐,他认为,将样品溶于水后充分搅拌,在空气中加热蒸干燃烧称量即可,请你评价是否可行?????????。(填“可行”或“不可行”)
|