时间:2017-01-17 23:19:49
1、选择题 若NA表示阿伏伽德罗常数,下列叙述中正确的是
A.1mol含8个碳原子的某烃分子,最多形成8mol碳碳单键
B.16.9g?过氧化钡(BaO2)固体中阴、阳离子总数为0.2NA
C.1mol?Cl2发生反应时,转移的电子数一定是2NA
D.精炼铜过程中阳极减轻6.4g时,电路中转移电子数一定是0.2NA
参考答案:B
本题解析:分析:A.考虑碳碳单键形成的空间结构;
B.过氧化钡(BaO2)固体中阴、阳离子之比为1:1;
C.氯气在反应中可作氧化剂也可作还原剂,转移电子数目在不同的情况下不一样;
D.依据电解精炼铜的原理和电极反应分析计算.
解答:A.1mol含8个碳原子的某烃分子,最多形成12mol碳碳单键,如分子式为C8H8的立方烷,故A错误;
B.过氧化钡(BaO2)是由过氧根离子和钡离子构成,两个氧形成一个过氧根离子,所以阴、阳离子之比为1:1,其摩尔质量为169g/mol,16.9g?过氧化钡(BaO2)的物质的量为0.1mol,所以阴、阳离子总数为0.2NA,故B正确;
C.氯气只作氧化剂时,1?mol?Cl2发生反应,转移的电子为2mol,但在发生歧化反应时,情况就有所不同了,例如,氯气与氢氧化钠反应时,1mol?Cl2发生反应时,转移的电子为1mol,故C错误;
D.电解精炼铜时阳极电极反应Cu-2e-=Cu2+,Fe-2e-=Fe2+,Zn-2e-=Zn2+,Ni-2e-=Ni2+,阴极电极反应为Cu2++2e-=Cu,若阴极得到电子数为0.2NA个,依据电子守恒,阳极失去的电子物质的量为0.2mol,为几种金属共失去的电子,不是铜失电子物质的量,固体质量减少不是6.4g,故D错误;
故选B.
点评:本题主要考查了化学键数目的计算、电解精炼铜、氧化还原电子数的计算等知识,是一道有关物质的量及阿伏加的罗常数的多考点题,题目解答时需细心,属于易错题,难度不大.
本题难度:一般
2、选择题 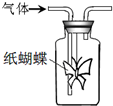 如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是
如图集气瓶中用滤纸折成的纸蝴蝶上喷洒了一种溶液,通入某种气体后,实验结果与预测的纸蝴蝶颜色变化不一致的是
A.A
B.B
C.C
D.D
参考答案:C
本题解析:分析:A.氨水能使酚酞试液变红;
B.次氯酸有漂白性,能使石蕊试液褪色;
C.酸性重铬酸钾具有强氧化性,能氧化乙醇而使自身变色;
D.淀粉遇碘变蓝色.
解答:A.氨气溶于水得到氨水,氨水电离出氢氧根离子而使氨水呈碱性,酚酞遇碱变红色,故A不选;
B.氯气溶于水生成盐酸和次氯酸,盐酸有酸性而使紫色石蕊试液变红,次氯酸有漂白性而使石蕊试液最终褪色,故B不选;
C.酸性重铬酸钾具有强氧化性,能氧化乙醇,而自身被还原,溶液由黄色变为绿色,故C选;
D.氧气能氧化酸化的碘化钾生成碘单质,淀粉遇碘变蓝色,故D不选;
故选C.
点评:本题考查元素化合物的性质,注意次氯酸能使酸碱指示剂褪色,而二氧化硫不能使酸碱指示剂褪色,为易错点.
本题难度:简单
3、选择题 下列叙述中,能证明某物质是弱电解质的是:
A.熔化时不导电
B.水溶液的导电能力很差
C.不是离子化合物,而是极性共价化合物
D.溶液中已电离的离子和未电离的分子共存
参考答案:D
本题解析:试题分析:在溶液中不完全电离,存在电离平衡的电解质是弱电解质,所以溶液中有已电离的离子和未电离的分子共存时,就可以说明该电解质是弱电解质,答案选D。
考点:考查弱电解质的有关判断
点评:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质。
本题难度:简单
4、选择题 设NA代表阿伏加德罗常数,如a克某气体中含有分子数b,则该气体的摩尔质量是
A.g/mol
B.g/mol
C.g
D.NAg
参考答案:A
本题解析:分析:先根据物质的量n=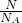 ,然后根据摩尔质量M=
,然后根据摩尔质量M=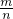 来解答.
来解答.
解答:该气体的物质的量n=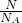 =
=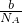 ,摩尔质量M=
,摩尔质量M=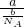 g/mol=
g/mol=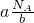 g/mol,
g/mol,
故选A.
点评:本题主要考查了摩尔质量的计算,难度不大,根据公式即可完成.
本题难度:一般
5、选择题 下列物质中不能与SO2反应的是
A.CaO
B.石灰水
C.盐酸
D.O2
参考答案:C
本题解析:酸性氧化物一般不与酸反应.
本题难度:困难