时间:2017-01-17 21:40:58
1、填空题 Ⅰ.铬位于第四周期ⅥB族,主要化合价+2,+3 ,+6,单质硬度大,耐腐蚀,是重要的合金材料。
(1)基态铬原子的价电子排布图___________,CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是________(填“极性”或“非极性”)分子。
(2)CrCl3·6H2O实际上是配合物,配位数为6,其固体有三种颜色,其中一种浅绿色固体与足量硝酸银反应时,1mol固体可生成2mol氯化银沉淀,则这种浅绿色固体中阳离子的化学式____________。
Ⅱ.砷化镓为第三代半导体材料,晶胞结构如图所示,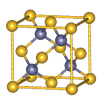
(3)砷化镓可由(CH3)3Ga和AsH3在700℃下反应制得,反应的化学方程式????为???????????。??
(4)AsH3空间构型为 ????????????????????。
已知(CH3)3Ga为非极性分子,则其中镓原子的杂化方式是_______。
(5)砷化镓晶体中最近的砷和镓原子核间距为a cm,砷化镓的摩尔质量为b g/mol,阿伏伽德罗常数值为NA,则砷化镓晶体密度的表达式_________ g/cm3。
参考答案:Ⅰ.(1)本题解析:
试题分析:Ⅰ.(1)铬是24号元素,其基态的价电子排布式是3d54S1,因此基态铬原子的价电子排布图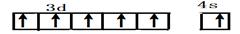 。因为CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶。根据相似相容原理,可判断出CrO2Cl2是非极性分子。(2) 浅绿色固体CrCl3·6H2O与足量硝酸银反应时,1mol固体可生成2mo
。因为CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶。根据相似相容原理,可判断出CrO2Cl2是非极性分子。(2) 浅绿色固体CrCl3·6H2O与足量硝酸银反应时,1mol固体可生成2mo
本题难度:一般
2、选择题 下列变化过程中无化学键断裂或生成的是???????????????????????????????[???? ]
A.石墨转化为金刚石
B.NaCl晶体溶于水
C.干冰升华
D.氮的固定
参考答案:C
本题解析:
本题难度:简单
3、计算题 C70分子是形如椭球状的多面体,该结构的建立基于以下考虑:
(1)C70分子中每个碳原子只跟相邻的3个碳原子形成化学键;
(2)C70分子中只含有五边形和六边形;
(3)多面体的顶点数、面数和棱边数的关系遵循欧拉定理:顶点数+面数-棱边数=2。 
根据以上所述确定
(1)C70分子中所含的单键数和双键数;
(2)C70分子中的五边形和六边形各有多少?
参考答案:(1)单键数:70;双键数:35
(2)设C70分子中
本题解析:
本题难度:一般
4、简答题 已知元素电负性的差值大于1.7时,原子间形成离子键,小于1.7时,原子间形成共价键,请指出下列原子之间形成的化学键是离子键还是共价键.
Be(1.5)和F(4.0):______,Si(1.8)和Cl(3.0):______.
参考答案:元素电负性的差值大于1.7时,原子间形成离子键,小于1.7时
本题解析:
本题难度:简单
5、选择题 据报道,意大利科学家合成了一种新型氧分子,它是由四个氧原子构成的。下列关于该分子的叙述正确的是 (???)
A.O2、O3、O4都是氧的同素异形体
B.O2、O3、O4都是氧的同位素
C.O4的摩尔质量为64
D.O2、O3、O4都互称为同分异构体
参考答案:A
本题解析:
试题分析:由同一种元素形成的不同单质互为同素异形体,据此可知想象A正确;质子数相同,中子数不同的同一种元素的不同核素互称为同位素,B不正确。摩尔质量的单位是g/mol,C不正确。分子式相同结构不同的化合物互为同分异构体,D不正确,答案选A。
点评:该题以新型的氧分子未载体,侧重对学生基础知识的巩固和检验,旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确同位素、同素异形体以及同分异构体的含义以及判断依据,然后灵活运用即可。
本题难度:一般