时间:2017-01-17 21:39:59
1、实验题 浓氨水可与新制生石灰作用生成氨气,干燥的氨气在高温下能被CuO氧化成N2实验室欲用图仪器装置和药品来制取纯净的氮气。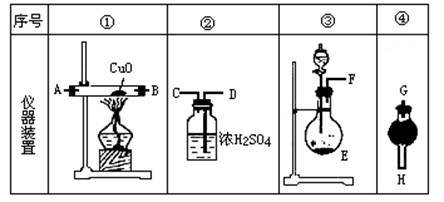
试回答下列问题:
(1)这些装置按气流方向自左向右的连接顺序是(填A、B、C……)____????____。
(2)E中发生反应的化学方程式是____??????????????????????????____。
(3)装置④中应当选用的干燥剂是(写名称)____???????_______。
(4)装置①中发生氧化还原反应的化学方程式是___?????????????????________。其中氧化剂是____??__,氧化产物是______??__(写化学式)。
(5)装置②中浓硫酸的作用是_____?????????????????????____。
参考答案:(1)F→G→H→A→B→D→C(A、B顺序可颠倒);(2)
本题解析:本题综合考查运用氧化还原反应等知识,以及气体制取、干燥、尾气吸收等实验技能,解决新情境下化学实际问题的能力。本题中生成氨气和氨氧化反应的原理及产物,不难根据题给的条件确定,不再赘述。在此基础上,可依题目叙述的顺序,将各步的条件、任务与备选装置结合起来,找出相应的仪器装置,再合理连接起来,以完成整体实验装置的选择与组装。浓氨水与新制生石灰作用生成氨气,属于固体与溶液反应制气体,应选用装置③;“干燥的氨气”暗示接下来应该是干燥气体的装置。鉴于浓硫酸吸收氨气生成硫酸铵,不是干燥氨气,而是吸收氨气的装置,此干燥装
本题难度:简单
2、填空题 不同金属离子在溶液中完全沉淀时,溶液的pH不同。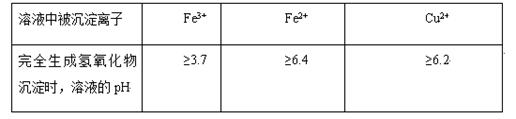
氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体,首先将其制成水溶液,然后按下面所示的操作步骤进行提纯。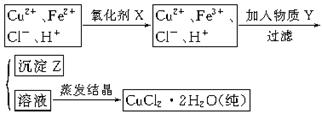
(1)下列氧化剂中适合作氧化剂X的是??????????????(填序号);
A.NaClO
B.H2O2
C.KMnO4
D.Cl2
(2)物质Y的化学式是??????????、????????????;(任写两种)
(3)写出从(2)题任选一个物质Y参与反应生成沉淀Z离子方程式:??????????????。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体????(填“能”或“不能”)。若能,不用回答;若不能,回答该如何操作??????????????????????。
(5)氢氧化铜常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于?????。
参考答案:(1)B、D;(2)CuO或Cu(OH)2或CuCO3;(3
本题解析:
试题分析:(1)在氯化铜晶体(CuCl2·2H2O)中含FeCl2杂质,为制得纯净氯化铜晶体应该把杂质除去。但是Fe2+形成沉淀的pH与Cu2+形成沉淀的pH很相近,不容易除去。若加入氧化剂把Fe2+氧化为Fe3+就很容易除去了。在选择氧化剂时不要引入新的杂质离子。所以应该选择绿色氧化剂B.H2O2或D.Cl2.(2)加入物质Y用以调节溶液的pH值,而且不引入杂质。可以加入CuO或Cu(OH)2或CuCO3或Cu2(OH)2CO3等。(3)假设以CuO为例,反应的两种方程式为2Fe3++6H2O+
本题难度:一般
3、填空题 (12分)铁单质及其化合物在生活、生产中应用广泛。请回答下列问题:
(1)钢铁在空气中发生吸氧腐蚀时,正极的电极反应式为 ______________________。
______________________。
(2)由于氧化性Fe3+>Cu2+,氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式是________。
(3)硫酸铁可作絮凝剂,常用于净水,其原理是______________________(用离子方程式表示)。在使用时发现硫酸铁不能使酸性废水中的悬浮物沉降而除去,其原因是__________。
(4)磁铁矿是工业上冶炼铁的原 料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。
料之一,其原理是Fe3O4+4CO3Fe+4CO2,若有1.5 mol Fe3O4参加反应,转移电子的物质的量是__________________。
(5)下表中,对陈述Ⅰ、Ⅱ的正确性及其有无因果关系的判断都正确的是________(填字母)。
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 | ||||||||||||
| A | 铁是地壳中含量最高的 金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对;有 | ||||||||||||
| B | 常温下铁与稀硫酸反应 生成氢气 | 高温下氢气能还原氧化 铁得到铁 | Ⅰ对;Ⅱ对;无 | ||||||||||||
| C | 铁属于过渡元素 | 铁和铁的某些化合物可用作催化剂 | Ⅰ错;Ⅱ对;无 | ||||||||||||
| D | 在空气中铁的表面能形 成致密的氧化膜 | 铁不能与氧气反应 | Ⅰ对;Ⅱ对;有 参考答案: 本题难度:一般 4、实验题 (10分)某氯化铁样品含有FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行: 参考答案: 本题难度:一般 5、填空题 CoxFe3-xO4磁粉是一种比较好的高矫顽力磁粉。工业上以FeSO4为原料制备CoxFe3-xO4的主要步骤如下:
|