时间:2017-01-17 21:39:39
1、选择题 已知常温下CH3COOH的电离平衡常数为Ka,常温下,向20mL 0.1 mol·L-1CH3COOH溶液中逐滴加入0.1 mol·L-1NaOH溶液,其pH变化曲线如图所示(忽视温度变化)。下列说法中错误的是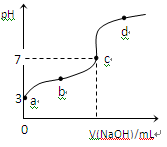
A.a点表示的溶液中由水电离出的H+浓度为1.0×10-11 mol·L-1
B.b点表示的溶液c(CH3COO-) > c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中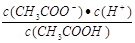 相等
相等
2、填空题 (12分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度 (mol·L-1) | NaOH物质的量浓度 (mol·L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | C1 | 0.2 | pH=7 |
| 丙 | 0.1 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=10 请回答下列问题: (1)不考虑其他组的结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸??????????????????????????????????????????????????????????。 (2)不考虑其他组的结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1???????(填“是”或“否”)。混合溶液中c(A-)与  c(Na+)离子浓度的大小关系是??????(填序号)。A.前者大??? B.后者大??? C.一样大???? D.无法判断 c(Na+)离子浓度的大小关系是??????(填序号)。A.前者大??? B.后者大??? C.一样大???? D.无法判断(3)从丙组结果分析,HA是????????酸(填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是????????????????????????????????????????????????????????。 (4)丁组实验所得混合溶液中由水电离出的c(OH-)=????????mol·L-1。 3、填空题 现有电解质溶液:①Na2CO3②NaHCO3③NaAlO2④CH3COONa⑤NaOH,且已知:CO2+3H2O+2 4、填空题 (5分)氨气的水溶液称为氨水,它的主要存在微粒是NH3·H2O。已知:a.常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5mol/L?? b.CH3COOH+NaHCO3=CH3COONa 5、选择题 |