3.2
则在pH=4的溶液中能够大量共存的离子组是
A.Fe 3+、Cu2+、Cl-、NO3- B.Fe 2+、K+、SO42-、NO3-
C.Cu2+、Na+、CO32-、SO42- D.Fe 2+、K+、SO42-、Cl-
参考答案:D
本题解析:
试题分析:离子间如果发生化学反应,则不能大量共存,反之是可以的。则A、根据表中数据可知,在pH=4时铁离子已经完全沉淀,则Fe 3+不能大量共存,A错误;B、pH=4溶液显酸性,在酸性溶液中Fe 2+与NO3-发生氧化还原反应而不能大量共存,B错误;C、Cu2+与CO32-在溶液中不能大量共存,C错误;D、Fe 2+、K+、SO42-、Cl-在pH=4的溶液中可以大量共存,D正确,答案选D。
考点:考查离子共存的正误判断
本题难度:一般
2、选择题 下表是五种银盐的溶度积常数(25℃)

下列说法不正确的是 [???? ]
A. 向Ag2SO4饱和溶液中加入Na2SO4固体后会生成白色沉淀
B. 将少量氯化银溶于水后,向其中加入一定量的Na2S,能生成黑色沉淀
C. 氯化银、溴化银和碘化银在常温下的溶解度依次增大
D. AgBr饱和溶液中加入一定量的NaCl也可能会生成AgCl沉淀
参考答案:C
本题解析:
本题难度:一般
3、选择题 (3分)下列说法不正确的是__________。
A.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
B.对于Al(OH)3(s)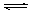 Al(OH)3(aq) Al(OH)3(aq) 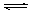 Al3++3OH-,前者 为溶解平衡,后者为电离平衡; Al3++3OH-,前者 为溶解平衡,后者为电离平衡;
C.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
参考答案:(3分) A C
本题解析:A错,如氢氧化钠溶解会放出热量;B正确,Al(OH)3(s)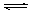 Al(OH)3(aq) Al(OH)3(aq) 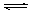 Al3++3OH-,前者为溶解平衡,后者为电离平衡;C错,除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;D正确,沉淀反应中常加过量的沉淀剂,其目的是使沉淀尽可能完全; Al3++3OH-,前者为溶解平衡,后者为电离平衡;C错,除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3小;D正确,沉淀反应中常加过量的沉淀剂,其目的是使沉淀尽可能完全;
本题难度:一般
4、选择题 氢氧化镁固体在水中达到溶解平衡Mg(OH)2(s) Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,可加入少量的(???) Mg2+(aq)+2OH-(aq)时,为使Mg(OH)2固体的量减少,可加入少量的(???)
A.NaOH
B.NH4Cl
C.MgSO4
D.NaHSO4
参考答案:BD
本题解析:Mg(OH)2(s) Mg2+(aq)+2OH-(aq),加入氯化铵,铵根和氢氧根结合生成一水合氨,氢氧根减少,平衡正向移动;硫酸氢钠消耗氢氧根,平衡正向移动,氢氧化镁量减少; Mg2+(aq)+2OH-(aq),加入氯化铵,铵根和氢氧根结合生成一水合氨,氢氧根减少,平衡正向移动;硫酸氢钠消耗氢氧根,平衡正向移动,氢氧化镁量减少;
本题难度:一般
5、选择题 下列说法不正确的是
A.BaCrO4(s)  Ba2+(aq)+ CrO42-(aq)的平衡体系中,加入BaCl2浓溶液沉淀量增多 Ba2+(aq)+ CrO42-(aq)的平衡体系中,加入BaCl2浓溶液沉淀量增多
B.pH=2的酸溶液与pH=12的强碱溶液等体积混合,所得溶液pH≤7
C.苯酚显色原理为:6C6H5OH+Fe3+ Fe(C6H5O)63-(紫色)+6H+,则检验水杨酸( Fe(C6H5O)63-(紫色)+6H+,则检验水杨酸(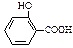 )中的酚羟基,需加入适量的小苏打溶液后,再加入氯化铁溶液 )中的酚羟基,需加入适量的小苏打溶液后,再加入氯化铁溶液
D.某试液中加入盐酸酸化的氯化钡溶液有白色淀淀,该试液中一定含有SO42-
参考答案:D
本题解析:A正确,Ba2+加入后产生同离子效应,沉淀增加;B正确,若为弱酸,则PH<7,若为强酸,则PH=7;C正确,水杨酸电离的H+会抑制平衡,难以显紫色,无法检验酚羟基;D错,还可能含有Cl-等。
本题难度:一般
|