时间:2017-01-17 10:36:04
1、选择题 已知某弱酸的酸式盐有NaH2XO4和Na2HXO4,其中NaH2XO4的溶液呈酸性,Na2HXO4溶液呈碱性。30℃时,浓度均为0.1mol?L-1NaH2XO4溶液和Na2HXO4溶液中均存在的关系是
A.c(H+)?c(OH-) >1×10-14
B.c(H+) + 2c(H3XO4)+ c(H2XO4-)=c(XO43-)+ c(OH-)
C.c(H+) + c(H3XO4)= c(HXO42-)+ 2c(XO43-)+ c(OH-)
D.c(Na+)+ c(H+)= c(H2XO4-)+ c(OH-)+ 2c(HXO42-)+ 3c(XO43-)
参考答案:AD
本题解析:NaH2XO4和Na2HXO4虽然溶液酸碱性不同,但溶液中离子种类是完全相同的,差别只是各种离子多少的不同。所以两种溶液中都存在相同的电荷守恒。因为温度高于25℃,此时水的离子积常数随温度升高而增大,所以A正确。
本题难度:简单
2、选择题 汽水是CO2的饱和溶液,其中存在如下平衡:
H2CO3 H++HCO3-……①??? HCO3-
H++HCO3-……①??? HCO3- H++CO32-……②
H++CO32-……②
将汽水倒入试管中分别进行下列实验,相应分析结论错误的是
A.加热、平衡①、②可能都向左移动
B.加入澄清石灰水,平衡①、②均向右移动
C.加入CaCO3悬浊液,CaCO3的溶解平衡向正方向移动
D.通入过量CO2或滴加氯水,溶液pH均减小
参考答案:D
本题解析:
试题分析:A、加热碳酸分解生成CO2和水,促使平衡向左移动,A正确;B、加入澄清的石灰水,溶液的碱性增强,降低氢离子的浓度,平衡①、②均向右移动,B正确;C、加入碳酸钙悬浊液,碳酸与碳酸钙结合生成可溶性的碳酸氢钙,促进碳酸钙的溶解,C正确;D、温度不变,再通入CO2,溶液的浓度不变,pH不变,D不正确,答案选D。
本题难度:一般
3、填空题 (18分)NOx、SO2是主要的大气污染物,科学处理这些污染物对改善人们的生存环境具有重要的现实意义。
(1)利用甲烷催化还原氮氧化物。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=???kJ?mol-1。
(2)利用氧化氮氧化物的流程如下: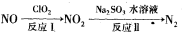
写出反应Ⅱ的化学方程式 ___________________;已知反应I的化学方程式为2NO+ClO2+H2O=NO2+HNO3+HCl,若反应I中转移0.5mol电子,则反应Ⅱ中可生成N2的体积
为_________L(标准状况下)。
(3)常温下,用NaOH溶液吸收SO2得到pH=9的Na2SO3溶液,吸收过程中水的电离平衡_________移动(填“向左”、“向右”或“不”);试计算溶液中 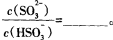 。
。
(常温下H2SO3的电离常数: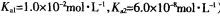 )
)
(4)利用Fe2(SO4)3溶液也可处理SO2废气,其流程如下图所示。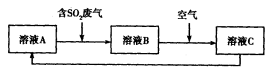
①简述用Fe2(SO4)3晶体配制溶液A的方法__________________。
②假设反应过程中溶液的体积不变,A、C两溶液的pH大小关系为:pH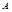 ___pH
___pH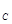 。(填
。(填
“>”、“=”或“<”)。
③设计实验验证溶液B是否仍具有处理废气的能力,简述实验的操作、现象和结论_____________________________________________________________________________。
参考答案:(l)—11601。(2)2NO2+4Na2SO3
本题解析: 本题难度:一般 4、选择题 已知醋酸达到电离平衡后,改变某条件使电离平衡向正反应方向移动了,则下列说法正确的是( ) 参考答案:A、因改变某条件使电离平衡向正反应方向移动,由HAc?H++ 本题解析: 本题难度:一般 5、选择题 下列关于电离常数(K)的说法中正确的是( ) 参考答案:A 本题解析: 本题难度:一般
试题分析:(l)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g);△H=-574kJ?mol-1
②CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g);△H=-867kJ?mol-1,根据盖斯定律:②×2—①,
则CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g);△H=—1160kJ?mol-1。(2)根据题给流程图知,反应Ⅱ为二氧化氮与亚硫酸钠溶液反应生成氮气和硫酸钠,化学方程式为2NO2+4Na2SO3
A.醋酸的电离程度一定增大
B.发生电离的分子总数增多
C.溶液的pH一定减小
D.溶液的导电能力一定变强
A.电离常数(K)越小,表示弱电解质电离能力越弱
B.电离常数(K)与温度无关
C.不同浓度的同一弱电解质,其电离常数(K)不同
D.多元弱酸各步电离常数相互关系为:K1<K2<K3
试题分析:电离常数与化学平衡常数类似,用来表示弱电解质的电离程度,电离常数(K)越小,表示弱电解质电离能力越弱,A正确;电离常数(K)只与温度有关系,B、C均不正确;多元弱酸各步电离常数相互关系为K1>K2>K3,D不正确,答案选A。
点评:该题是基础性试题的考查,主要是考查学生对电离平衡常数的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生分析、归纳和总结问题的能力。