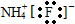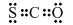1、选择题 下列叙述正确的是( )
A.离子化合物可能含共价键,共价化合物中不含离子键
B.构成单质分子的微粒一定含有共价键
C.由非金属元素组成的化合物不一定是共价化合物
D.只有在活泼金属元素和活泼非金属元素化合时,才能形成离子键
2、选择题 下列有关化学用语表示正确的是( )
A.氟化铵的电子式
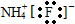
B.次氯酸的结构式为??H-Cl-O
C.COS的电子式是
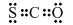
D.
?
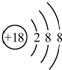
188
O2-粒子结构示意图:
3、选择题 CO.BF3.CCl4.CH4都是非极性分子,而NH3.H2S.H2O都是极性分子。由此推出ABn型分子是非极性分子的经验规律正确的是 [???? ]
A.所有原子在同一平面内
B.分子中不含氢原子
C.A的原子量小于B
D.在ABn分子中A原子化合价的绝对值等于其最外层电子数
4、选择题 X元素最高氧化物对应的水化物为H3XO4,则它对应的气态氢化物为[???? ]
A.HX
B.H2X
C.XH4
D.XH3
5、填空题 (4分)下面是你熟悉的物质:
①O2② 金刚石 ③ NaBr ④ H2SO4⑤ Na2CO3⑥ K2S?⑦NaHSO4
小题1:这些物质中,只含共价键的是_______________;只含离子键的是___________;既含共价键又含离子键的是_______________。
小题2:将NaHSO4溶于水,写出其电离方程式______________________________。
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G