????Ag2S
????颜色
????白
????黄
????黑
Kw(25℃)
????1.8×10-10
????1.5×10-16
????1.8×10-50
下列叙述正确的是( )
A.达到沉淀溶解平衡时,难溶电解质不再溶解
B.25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同
C.若先加入足量Na2S溶液,再加入KI溶液,则无黄色沉淀产生
D.25℃时,AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶度积不同
参考答案:A.难溶电解质溶液中存在溶解平衡,得到平衡状态时,物质的溶解
本题解析:
本题难度:简单
2、选择题 常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是

A.a、c两点均可以表示常温下CaS04溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定等于3×l0-3mol/L
D.向d点溶液中加入适量CaCl2固体可以变到c点
参考答案:B
本题解析:
考查Ksp。Ksp是一个常数,只跟温度有关,温度不变溶度积常数不变。a、c恰好为平衡点,d为不饱和溶液;b为过饱和溶液,将有晶体析出;
B.a点对应的Ksp等于c点对应的Ksp
本题难度:简单
3、选择题 已知,常温下,KSP (AgCl)=1.8×10-10 mol2·L-2,KSP(AgI)=8.3×10-17 mol2·L-2,下列叙述中,正确的是
A.常温下,AgCl在饱和NaCl溶液中的KSP比在纯水中的KSP小
B.向AgCl的悬浊液中加入KI溶液,沉淀由白色转化为黄色
C.将0.001 mol·L-1的AgNO3溶液滴入KCl和KI的混合溶液中,一定先产生AgI沉淀
D.向AgCl的饱和溶液中加入NaCl晶体,有AgCl析出且溶液中c(Ag+)=c(Cl-)
参考答案:B
本题解析:考查溶解平衡
A:KSP只与温度有关,不正确
B:由于KSP (AgCl)>KSP(AgI),向AgCl的悬浊液中加入KI溶液,I—将结合Ag+形成AgI沉淀,并且促进AgCl溶解平衡的正向进行,正确
C:是否产生沉淀,还与溶液中I—、Cl—的浓度有关,不正确
D:AgCl的饱和溶液中,c(Ag+)=c(Cl-),但加入NaCl晶体后,c(Cl-)增大,c(Ag+)<
本题难度:一般
4、选择题 (3分)下列说法不正确的是__________。
A.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的;
B.对于Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq)  Al3++3OH-,前者为溶解平衡,后者为电离平衡; Al3++3OH-,前者为溶解平衡,后者为电离平衡;
C.除去溶液中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2的溶解度比MgCO3大
D.沉淀反应中常加过量的沉淀剂,其目的是使沉淀完全。
参考答案:(3分)? A C
本题解析:A错,如氢氧化钠溶解会放出热量;B正确,Al(OH)3(s) Al(OH)3(aq) Al(OH)3(aq)  ?Al3++3OH-,前者为溶 ?Al3++3OH-,前者为溶
本题难度:一般
5、实验题 菱镁矿是碱性耐火材料的主要原料,其主要的化学成分是:MgCO3,同时含有杂质:SiO2、Al2O3、Fe2O3、CaO等;目前以菱镁矿为主要原料制备MgSO4的方法如下:

已知:①常温下,Fe3+、Al3+、Mg2+开始形成氢氧化物沉淀和沉淀完全时的pH值如下:
?
| Fe3+
| Al3+
| Mg2+
| 开始沉淀
| 2.1
| 3.7
| 9.0
| 沉淀完全
| 3.2
| 5.2
| 12.4
②MgSO4·7H2O在70~80℃时失去3个结晶水,300℃时失去全部的结晶水;
(1)用平衡原理解释:菱镁矿粉粹后加热生成的氧化镁可以溶解在硫酸铵溶液中的原因 ????????????????????????????????????????????????????????????????????。
(2)在该工业流程中,可以循环使用的物质是?????????????。
(3)步骤③中氨气和硫酸恰好完全反应,取此时所得的溶液10.00mL配成250mL溶液,配制溶液过程中除烧杯、玻璃棒、胶头滴管、酸式滴定管外,还需要的玻璃仪器有:?????????????;经检测所配制的溶液pH=1,c(SO42ˉ)=1.05mol/L,试求算所配制溶液中NH4+ 水解的平衡常数K(写计算过程,计算结果保留三位有效数字)。
(4)在加热条件下杂质中的三氧化二铁溶于硫酸铵的离子反应方程式是:
??????????????????????????????????????????????????????????????????????。
(5)蒸发结晶过程中需要使用60~70℃水浴加热方式,其原因是?????????????????。
参考答案:(16分)
(1)因NH4++H2O
本题解析:
试题分析:(1)硫酸铵溶液中存在如下水解平衡:NH4++H2O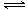 NH3?H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3 NH3?H2O+H+,氧化镁与氢离子反应,生成镁离子和水,减小氢离子浓度,促进铵根离子的水解平衡右移,生成的氢离子又溶解菱镁矿粉粹后加热生成的氧化镁;(2)步骤③生成硫酸铵,步骤②消耗硫酸铵,说明该工艺流程中,硫酸铵是可以循环利用的物质;(3
本题难度:困难
|
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
|