时间:2017-01-17 09:49:36
1、选择题 含有非极性键且分子中各原子都满足8电子稳定结构的是
[???? ]
参考答案:D
本题解析:
本题难度:简单
2、选择题 能用键能大小解释的是( )
A.N2的化学性质比O2稳定得多
B.常温常压下,溴呈液态,碘呈固态
C.稀有气体一般很难发生化学反应
D.硝酸易挥发而磷酸难挥发
参考答案:A
本题解析:
本题难度:简单
3、填空题 元素X的基态原子中的电子共有7个能级,且最外层电子数为1,X原子的内层轨道全部排满电子。在气体分析中,常用XCl的盐酸溶液吸收并定量测定CO的含量,其化学反应如下:
2XCl+2CO+2H2O=X2Cl2·2CO·2H2O
⑴X基态原子的电子排布式为?????。
⑵C、H、O三种原子的电负性由大到小的顺序为?????。
⑶X2Cl2·2CO·2H2O是一种配合物,其结构如图所示: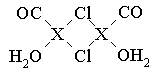
①与CO为互为等电子体的分子是?????。
②该配合物中氯原子的杂化方式为?????。
③在X2Cl2·2CO·2H2O中,每个X原子能与其他原子形成3个配位键,在图中用“→”标出相应的配位键?????。
⑷XCl的晶胞如图所示,距离每个X+最近的Cl—的个数为?????。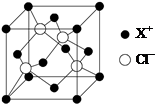
参考答案:
⑴1s22s22p63s23p63d104s1或[A
本题解析:
试题分析:(1)X电子排布式为1s22s22p63s23p63d104s1,是铜元素;(2)非金属性越强电负性越大,所以为O>C>H;(3)①N2;②根据图示观察,每个氯原子有7个电子与铜的1个电子行成共价键,与另一个铜原子形成配位键,共有4个价电子对,故为sp3杂化;③碳、氧均有孤对电子,形成配位键如上图所示。(4)图示晶胞中不能观察到完成的X成键,但根据Cl原子的成键情况判断X情况,图中观察到每个Cl原子周围有4个X距离最近,因XCl个数比为1:1,故距离每个X+最近的Cl—的个数是4个。
本题难度:一般
4、选择题 下列物质中微粒的个数比不是1:1的是
A.NaHCO3晶体中的 阴离子和阳离子
B.Na2O2固体中的阴离子和阳离子
C.重氢( H)原子中的质子和中子
D.NH3分子中的质子和电子
参考答案:B
本题解析:略
本题难度:一般
5、选择题 下列化学式及结构式中成键情况不合理的是[???? ]
A. CH3N 
B. CH2SeO 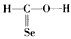
C. CH4S 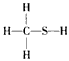
D. CH4Si 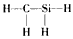
参考答案:D
本题解析:
本题难度:简单