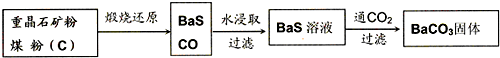
1
2
O2(g)=CO(g);△H=-110.5kJ?mol-1
Ba(s)+S(s)=BaS(s);△H=-460kJ?mol-1
(2)经检验BaS的水溶液呈碱性,原因是(用离子方程式表示):______.
●沉淀转化法
向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液.如此处理多次,直到BaSO4全部转化为BaCO3:BaSO4(s)+CO32-(aq)≒BaCO3(s)+SO42-(aq)(平衡常数K=0.042)
(3)现有0.20mol?BaSO4,每次用1.00L?2.0mol?L-1饱和Na2CO3溶液处理,假定BaSO4能全部转化,至少需要处理多少次?(写出计算过程)
(4)从“绿色化学”角度分析,用饱和Na2CO3溶液沉淀转化法的优点是______.
参考答案:(1)根据盖斯定律:a、Ba(s)+S(s)+2O2(g)=
本题解析:
本题难度:一般
2、选择题 下列说法正确的是[???? ]
A.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
B.蔗糖、硫酸钡、水分别属于非电解质、弱电解质和弱电解质
C.Mg、Al、Cu可以分别用置换法、直接加热法和电解法冶炼得到
D.由热化学方程式:C(s)+O2(g)==CO2(g) △H1;2CO(g)+O2(g)==2CO2(g) △H2;
C(s)+1/2O2(g)==CO(g) △H3;则△H3 =△H1-1/2△H2
参考答案:D
本题解析:
本题难度:简单
3、填空题 钢铁工业在我国国民经济中处于十分重要的位置,工业上采用高炉冶炼,常用赤铁矿、焦炭、空气和熔剂(石灰石)作原料.已知赤铁矿被还原剂还原时是逐级进行的,还原时温度及CO、CO2平衡混合气体中CO的体积分数的关系如图:
(1)铁在元素周期表中位于______周期______族.
(2)在温度低于570℃时,还原分两阶段完成,在温度高于570℃时,依次发生的还原反应有:______(选用右图中的a、b、c、d填空).
(3)为减少高炉冶铁时,含CO的尾气排放,下列研究方向不可取的是______.
(a)其它条件不变,增加高炉的高度
(b)调节还原时的炉温
(c)增加原料中焦炭与赤铁矿的比例
(d)将生成的铁水及时移出
(4)已知下列反应数值:
| 反应序号 | 化学反应 | 反应热
①
Fe2O3(s)+3CO(g)=2Fe(s)+3CO?2(g)
△H1=-26.7kJ?mol-1
②
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g)
△H2=-50.8kJ?mol-1
③
Fe3O4(s)+CO(g)=3FeO(s)+CO2?(g)
△H3=-36.5kJ?mol-1
④
FeO(s)+CO(g)=Fe(s)+CO2(g)
△H4
反应④△H4=______kJ?mol-1.
(5)1100℃时,FeO(s)+CO(g)?Fe(s)+CO2(g),平衡常数K=0.4.今在一密闭容器中,加入7.2gFeO,同时通入4.48LCO(已折合为标准状况),将其升温到1100℃,并维持温度不变,达平衡时,FeO的转化率为:______.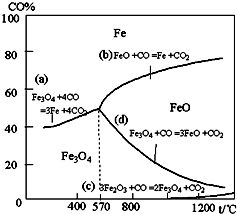
参考答案:(1)铁是26号元素,位于元素周期表中位于 第四周期第Ⅷ族.
本题解析:
本题难度:一般
4、选择题 CH4与Cl2反应的历程有:
①Cl-Cl→2Cl?△H=243kJ?mol-1
②Cl?+CH3-H→?CH3+H-Cl△H=4kJ?mol-1
③?CH3+Cl-Cl→CH3-Cl+Cl?△H=-106kJ?mol-1
则反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g)的焓变应为( ) A.110kJ?mol-1
B.141kJ?mol-1
C.-102kJ?mol-1
D.102kJ?mol-1
参考答案:C
本题解析:
本题难度:简单
5、简答题 本题包括两个小题
A.①CaCO3(s)═CaO(s)+CO2(g);△H=-177.7kJ/mol
②0.5H2SO4(l)+NaOH(l)═0.5Na2SO4(l)+H2O(l);△H=-57.3kJ/mol
③C(s)+O2(g)═CO2(g);△H=-393.5kJ/mol
④CO(g)+1/2O2(g)═CO2(g);△H=-283kJ/mol
⑤HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(l);△H=-57.3kJ/mol
(1)上述热化学方程式中,不正确的有______.(填序号,以下同)
(2)上述反应中,表示燃烧热的热化学方程式是______;
上述反应中,表示中和热的热化学方程式是______.
B.已知热化学方程式:
C(S,金刚石)+O2(g)=CO2(g)△H=-395.41KJ/mol,
C(S,石墨)+O2(g)=CO2(g)△H=-393.51KJ/mol
则金刚石转化为石墨的热化学方程式为______,由热化学方程式看来更稳定的碳的同素异形体是______.
参考答案:A(1)①CaCO3═CaO(s)+CO2(g)△H=-17
本题解析:
本题难度:一般
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
|
|