时间:2017-01-16 17:46:52
1、选择题 硅及其化合物在材料领域中应用广泛。下列说法正确的是
A.硅酸钠可用于制备木材防火剂
B.硅单质广泛用于光纤通讯
C.利用盐酸刻蚀石英制作艺术品
D.水晶项链是硅酸盐制品
参考答案:A
本题解析:
试题分析:A、硅酸钠可用于制备木材防火剂,正确;B、硅单质广泛用于光纤通讯的是二氧化硅,而不是硅单质,错误;C、盐来源:91 考试网酸与石英不反应,不能利用盐酸刻蚀石英制作艺术品,而应用氢氟酸,错误;D、水晶项链的成分是二氧化硅,错误。
本题难度:简单
2、选择题 有关二氧化硅的叙述不正确的是(???????)
A.属于酸性氧化物
B.与所有的酸都反应
C.能与强碱反应
D.在一定条件下能与生石灰反应
参考答案:B
本题解析:
试题分析:二氧化硅只与氢氟酸反应,故B错误;
二氧化硅能与氢氧化钠反应生成硅酸钠和水,故C正确;
二氧化硅能与氢氧化钠反应生成硅酸钠和水,属于酸性氧化物,故A正确;
一定条件下二氧化硅能与生石灰反应生成硅酸钙,故D正确
点评:本题主要考查了二氧化硅的化学性质,难度不大,要加强记忆
本题难度:一般
3、选择题 下列关于二氧化硅的说法,错误的是(??)
A.二氧化硅也叫硅酐
B.二氧化硅分子由一个硅原子和两个氧原子构成
C.不能用二氧化硅跟水直接作用制取硅酸
D.二氧化硅既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物
参考答案:BD
本题解析:二氧化硅不存在单个分子,它是空间网状结构;二氧化硅与烧碱反应,表现出酸性氧化物的通性,但它与氢氟酸的反应却不是碱性氧化物的通性,因为它除了与氢氟酸反应外,其他的酸都不能与之反应。
本题难度:一般
4、填空题 获取知识和信息是现代人不可缺少的素质,信息产业的飞速发展离不开材料科学的推动。信息产业的核心材料是高纯度的硅,单晶硅可用来制作大规模集成电路、整流器等,硅纯度越高,大规模集成电路的性能就越好。高纯度的单晶硅生产方法有:
方法一:三氯甲硅烷(SiHCl3)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: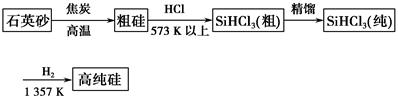
方法二:用金属硅化物(Mg2Si)与盐酸作用制得硅烷,再热分解硅烷可得高纯硅。
根据上述信息回答以下问题:
(1)从方法一生产单晶硅的过程看,由焦炭还原得到的硅为何还要进一步处理?_________________________________________________________。
(2)写出方法二中生产高纯硅的两个化学方程式:
①____________________________________________________________;
②__________________________________________________________。
(3)写出由纯SiHCl3制备高纯硅的化学方程式:____________________________________。
(4)在方法一中,整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:________________;H2还原SiHCl3过程中若混入O2,可能引起的后果是_____________________________________________________。
(5)比较方法一和方法二,分析一下各自的优缺点____________________________________。
参考答案:(1)由C还原SiO2得到的单质硅中,杂质含量过高,将它用H
本题解析:(1)C还原SiO2得到的单质硅是粗硅,杂质的含量高,需要进一步的提纯处理;(2)Mg2Si与盐酸作用生成硅烷,同时生成MgCl2;(3)注意副产物为HCl;(4)SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学方程式:SiHCl3+3H2O=H2SiO3+H2↑+3HCl;H2还原SiHCl3过程中若混入O2,可能引起的后果是:高温下,H2遇O2发生爆炸。
本题难度:一般
5、填空题 下图为一定量饱和Ca(OH)2溶液中通入二氧化碳气体后,产生CaCO3白色沉淀的质量与二氧化碳体积之间的关系曲线。试完成下列问题: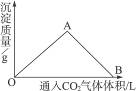
OA段曲线和AB段曲线所表示的反应方程式是
OA:_________________________________________________________________________;
AB:_________________________________________________________________________。
A点时已参加反应的CO2和Ca(OH)2的物质的量之比为_______________。
B处溶液中存在的浓度较大的两种离子是_____________和_____________(填离子符号)。
将B处生成的溶液煮沸,可见到的现象是______________________________。
参考答案:Ca(OH)2+CO2====CaCO3↓+H2O
C
本题解析:这是一道涉及碳酸正盐和碳酸氢盐互变规律的试题。如果能把握住下述规律,解题就会变得轻而易举。
(1)碳酸的正盐与过量的CO2反应时生成碳酸氢盐。
(2)碳酸氢盐与碱反应时生成碳酸的正盐和水。
(3)碳酸氢盐在加热条件下生成碳酸正盐、水和CO2。
OA段曲线表示在Ca(OH)2饱和溶液中,随着CO2通入量的增加,生成的CaCO3沉淀逐渐增多。其发生的化学反应为:
Ca(OH)2+CO2====CaCO3↓+H2O?????????????????????????????????
本题难度:简单