时间:2017-01-16 17:36:36
1、填空题 在①H2O2、②NaOH、③CaF2、④Na2O2中,只含有离子键的是(本题填编号)__________,既含有极性共价键又含有离子键的是___________,既含有离子键又含有非极性键的是????___?? ,既含有非极性共价键又含有极性共价键的是??___????????。
参考答案:③ ;② ;④ ;①
本题解析:
本题难度:一般
2、选择题 下列关于化学键的说法中正确的是[???? ]
A.单质分子一定含有共价键
B.非极性键只存在于双原子单质分子里
C.由非金属元素原子组成的化合物不一定是共价化合物
D.不同元素组成的多原子分子里的化学键一定是极性键
参考答案:C
本题解析:
本题难度:简单
3、选择题 有A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,原子的第一电离能E﹤A, R是地壳中含量最高的金属元素,X原子核外的M层中有三对成对电子,Y为周期表前四周期中电负性最小的元素, Z原子核外电子数为24。
请回答下列问题:
(1)基态Z原子的核外电子排布式是?????。AE2+与二氧化碳分子互为等电子体,AE2+的电子式是____。AX3分子的VSEPR模型是?????。
(2)某化合物由E、Y两种元素组成,其晶胞如图,该化合物的化学式为______。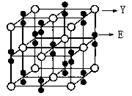
(3)在化合物Y2ZE4的水溶液入适量硫酸,能观察到的现象是??????。
(4)A的简单氢化物极易溶于E的简单氢化物,其原因是??????????。
(5)A的最高价氧化物对应水化物的稀溶液与R的单质反应时,A被还原到最低价,该反应的化学方程式是????????????????????????????????????????????。
参考答案:(1)1s22s22p63s23p63d54s1或[Ar])
本题解析:
试题分析:根据题给信息知,A、E、R、X、Y、Z六种前四周期元素,原子序数依次增大,基态A原子的2p轨道处半充满状态,则A为氮元素;原子的第一电离能E﹤A,结合题给信息知E为氧元素; R是地壳中含量最高的金属元素,则R为铝元素;X原子核外的M层中有三对成对电子,则X为氯元素;Y为周期表前四周期中电负性最小的元素,则Y为钾元素; Z原子核外电子数为24,则铬元素。(1)Z为铬元素,基态铬原子的核外电子排布式是1s22s22p63s23p63d54s1或[Ar])3d54s1;NO2+与二氧化碳分子互
本题难度:一般
4、填空题 如图所示每条折线表示周期表ⅣA~ⅦA族中某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是____________,b点代表的是__________。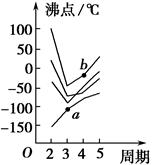
参考答案:SiH4?? H2Se
本题解析:第二周期ⅣA~ⅦA族元素分别是C、N、O、F,其氢化物的沸点由高到低的顺序是
H2O>HF>NH3>CH4,因此,由上至下4条折线分别代表ⅥA、ⅦA、ⅤA、ⅣA族元素的氢化物的沸点变化。那么,b点代表的物质是H2Se,a点代表的物质是SiH4。
本题难度:一般
5、填空题 一般认为:如果两个成键元素间的电负性差值大于1.7,它们之间通常形成离子键;如果两个成键元素间的电 负性差值小于1.7,它们之间通常形成共价键。请查阅下列化合物中元素的电负性数值,判断它们是离子化合物还是共价化合物。 
①NaCl ②AlCl3 ③NO ④MgO ⑤BeCl2 ⑥CO2
共价化合物________;离子化合物_________。
参考答案:②③⑤⑥;①④
本题解析:
本题难度:一般