时间:2017-01-16 17:36:36
1、选择题 已知Zn2+的4s轨道和4p轨道可以形成sp3型杂化轨道,那么[ZnCl4]2—的空间构型为(?????? )
A.直线型
B.平面正方形
C.正四面体型
D.正八面体型
2、选择题 在短周期中的X和Y两种元素可组成化合物XY3,则下列说法中正确的是(?? )
A.若X的原子序数是m,则Y的原子序数必定是m 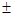 4
4
B.XY3晶体一定属于离子晶体
C.X与Y可属于两个不同周期,也可属于同一周期
D.X的原子半径小于Y的原子半径
3、选择题 下列说法不正确的是( )
A.在共价化合物中一定含有共价键
B.含有离子键的化合物一定是离子化合物
C.含有共价键的化合物一定是共价化合物
D.化学反应过程中,反应物分子内的化学键断裂,产物分子的化学键形成
4、填空题 对于HCl、H2SO4、NaOH、NaCl、Ne、金刚石、N2,回答下列问题:
(1)不存在化学键的是___________。
(2)属于共价化合物的是______、_______。
(3)属于离子化合物的是_______、________。
5、选择题 (2010·济宁)下列说法不正确的是 ?( )
A.σ键比π键重叠程度大形成的共价键强
B.两原子形成共价键时最多有一个σ键
C.气体单质中,一定有σ键,可能有π键
D.N2分子中有一个σ键,2个π键