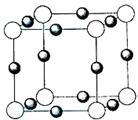
A?????????????? B????????????? C????????????? D
?
?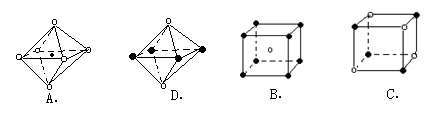
参考答案:(1)N>O>C???(2)π?? σ???(3
本题解析:
试题分析:(1)同周期随着原子序数的增加,第一电离能逐渐增加,但是IIA、IIIA族反常,VA、VIA族反常。所以C、N、O的第一电离能N>O>C。(2)N2中存在一个σ键和2个π键,又知N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-1,可求得π键键能为347.5 kJ·mol-1,所以π键比σ键稳定。(3)NH2-为NH3失去一个氢离子得到的离子,其电子式为 本题难度:一般
本题难度:一般
2、选择题 下列分子中有关原子不满足最外层8电子稳定结构的是[???? ]
A.五氯化磷
B.光气(化学式为:COCl2)
C.二硫化碳
D.三氯化硼
参考答案:AD
本题解析:
本题难度:简单
3、选择题 ①PH3的分子构型为三角锥形,
②BeCl2的分子构型为直线形,
③CH4分子的构型为正四面体形,
④CO2为直线形分子,
⑤BF3分子构型为平面正三角形,
⑥NF3分子结构为三角锥形。
下面对分子极性的判断正确的是 [???? ]
A.①⑥为极性分子,②③④⑤为非极性分子
B.只有④为非极性分子,其余为极性分子
C.只有②⑤是极性分子,其余为非极性分子
D.只有①③是非极性分子,其余是极性分子
参考答案:A
本题解析:
本题难度:简单
4、选择题 在下列分子结构中,原字的最外层电子不能满足8电子稳定结构的是

A.CO2
B.PCl3
C.CCl4
D.BF3
参考答案:D
本题解析:略
本题难度:一般
5、填空题 (8分)1994年度诺贝尔化学奖授予为研究臭氧做出贡献的化学家。O3能吸收有害紫外线,保护人类赖以生存的空间。O3的分子结构如图,呈V型,两个O----O键的夹角为116.5o。三个原子以一个O原子为中心,另外两个O原子分别构成一个共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键------三个O原子均等地享有这4个电子。请回答:?
 ?
?
(1)臭氧与氧气互为____________________,
(2)下列分子中与O3分子的结构最相似的是_____(填选项字母);
A.H2O
B.CO2
C.SO2
D.BeCl2
(3)分子中某原子有一对或几对没有跟其他原子共用的价电子叫孤对电子,那
么O3分子有?????????????对孤对电子。
(4)O3分子是否为极性分子????????????。(填是或否)
(5)O3具有强氧化性,它能氧化PbS为PbSO4而O2不能,试配平:
_____ PbS? +_____ O3? ="===_____" PbSO4 + _____ O2
生成1mol O2的转移电子物质的量为__________ mol。
参考答案:(1)同素异形体?(2)C?(3)5??(4)是(每空1分)
本题解析:(1)氧气和臭氧都是由氧元素形成的不同单质,所以二者互为同素异形体。
(2)S原子和氧原子属于同一主族,因此将臭氧中的1个氧原子用原子代替,即得到SO2,所以SO2的结构和臭氧是相似的。
(3)根据臭氧的结构可知,中间的氧原子还有2个电子没有参与成键,两侧的氧原子还各有4和电子没有参与成键,因此含有的孤对电子是(2+4+4)÷2=5。
(4)臭氧是V型结构,因此是极性分子。
(5)反应中S的化合价从-2价升高到到+6价,失去8个电子。氧元素的化合价从0价降低到-2价,得到2个电子,
本题难度:一般