时间:2017-01-16 17:07:32
1、选择题 用0.2mol/L HCl溶液滴定0.2mol/L NaOH,如果到达滴定的终点时不慎多加了1滴盐酸溶液(1滴溶液的体积约为0.05mL),继续加水至100mL,所得溶液的pH是????
A.4
B.1
C.1 0
D.3.3
参考答案:A
本题解析:试题分析:如果到达滴定的终点时不慎多加了1滴盐酸溶液(1滴溶液的体积约为0.05mL),则盐酸过量,溶液显酸性,所以反应后溶液中氢离子浓度=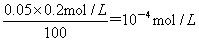 ,则pH=4,答案选A。
,则pH=4,答案选A。
考点:考查溶液pH的计算
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查。在注重对学生基础知识巩固和训练的同时,侧重对学生答题能力的培养和训练,旨在考查学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和应试能力。
本题难度:简单
2、选择题 下列实验操作中正确的是
A.利用电泳现象区别溶液和胶体
B.用滤纸过滤除去溶液中的胶体粒子
C.用渗析法除去胶体中的离子或分子,以净化胶体
D.向Fe(OH)3胶体中加入足量AgNO3溶液,以除去胶体中的Cl-
参考答案:C
本题解析:AgNO3溶液不但能除去Fe(OH)3胶体中的Cl-,还能使Fe(OH)3胶体中的Fe(OH)3发生聚沉.
本题难度:困难
3、选择题 将某溶液逐滴加入氢氧化铁溶胶内,开始时产生沉淀,继续滴加,沉淀又会逐渐溶解,该溶液是
A.稀硫酸溶液
B.氢氧化钠溶液
C.硫酸镁溶液
D.硅酸溶胶
参考答案:A
本题解析:解析:氢氧化铁胶体中的胶粒由于容易吸附溶液中的阳离子而带正电,当向其中加入含有阴离子的电解质溶液后,电解质溶液中的阴离子能中和胶粒所带的电荷,破坏胶体的介稳性而形成沉淀.电解质溶液中阴离子所带的负电荷越多,破坏Fe(OH)3胶体介稳性的能力越强.但形成的Fe(OH)3沉淀能继续和酸发生反应而逐渐溶解.硅酸不与Fe(OH)3沉淀反应.
评注:使胶体聚沉的方法主要有:①加热;②加入电解质溶液;③加入带相反电荷的胶体.
本题难度:简单
4、选择题 将0.1 mol·L-1的HCl和0.06 mol·L-1的Ba(OH)2溶液以等体积混合后,该混合溶液的pH是
A.1.7
B.12.3
C.12
D.2
参考答案:C
本题解析:
本题难度:困难
5、选择题 常温下,AgI的溶度积是8.3×10-17,在该温度下把0.01L浓度为8.0×?10-6mol/L的AgNO3溶液和0.01L浓度为4.0×10-7?mol/L的KCl溶液混合,下列说法正确的是(溶液体积变化忽略不计)
A.不能确定有无AgI沉淀生成
B.没有AgI沉淀生成
C.有KNO3晶体析出
D.有AgI沉淀生成
参考答案:D
本题解析:混合后浓度分别为4.0×10-6mol/L和2.0×10-7 mol/L;Q=4.0×10-6mol/L×2.0×10-7 mol/L=8.0×10-13>Ksp;故有沉淀析出。
本题难度:简单