时间:2017-01-16 17:07:12
1、选择题 用铂电极(惰性)电解下列溶液时,阴极和阳极上的主要产物分别是H2和O2的是?[???? ]
A.稀NaOH溶液?????????
B.HCl溶液
C.酸性CuSO4溶液???????
D.酸性AgNO3溶液
参考答案:A
本题解析:
本题难度:一般
2、选择题 现有用离子交换膜(只允许对应的离子通过)和石墨作电极的电解槽电解饱 和的Na2SO4溶液生产NaOH和H2SO4,下列说法中正确的是
和的Na2SO4溶液生产NaOH和H2SO4,下列说法中正确的是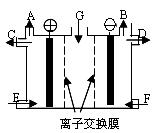
A.气体A是H2 ,溶液E是稀硫酸
B.气体B是H2 ,溶液D是NaOH溶液
C.Na2SO4溶液由G口加入,F口加入稀硫酸
D.靠阳极室一侧的是阳离子交换膜,阴极室导出的是氢气
参考答案:B
本题解析:略
本题难度:一般
3、选择题 关于下列图示的说法中不正确的是 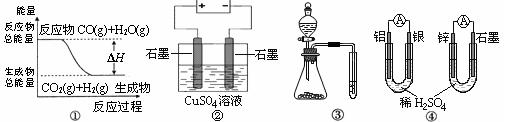
A.图①表示CO(g)+H2O(g) CO2(g)+H2(g)是放热反应
CO2(g)+H2(g)是放热反应
B.图②为电解硫酸铜溶液的装置,电解一段时间后,加入一定量的Cu(OH)2一定不能使溶液恢复到电解前的浓度和体积
C.图③实验装置可一次而又科学准确的完成比较HCl、H2CO3、H2SiO3酸性强弱的实验
D.图④两个装置中通过导线的电子数相同时,正极生成气体的物质的量也相同
参考答案:B
本题解析:略
本题难度:简单
4、填空题 (10分)
(1)高纯铜(纯度可达99.99%)广泛应用于电器工业。某粗铜样品中含Fe、Ni、Ag、Au等四种金属杂质,可用电解法进行精炼制得高纯铜。
请在如图中标明电极材料和电解质溶液的名称
已知Ni的金属活动性介于Fe和Sn之间。则精炼完成后,在阳极底部的沉积物中可回收到的金属为 ________(填化学式)。
(2)若在实验室中完成此实验,可用铅蓄电池做电源。铅蓄电池的电池总反应式为:
2PbSO4+2H2O  ?Pb+PbO2+4H++2SO42-
?Pb+PbO2+4H++2SO42-
在完全放电耗尽PbO2和Pb时,若按上图所示连接进行充电,充电一段时间后,则在A电极上生成__________(填化学式),B电极上生成________(填化学式);充电完毕,铅蓄电池的正极是________极(填“A”或“B”)
(3)在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重0.16 g。请回答下列问题:
①B电极的反应式_____________________。
②原溶液的物质的量浓度是_________________;电解后溶液的pH为 ________。(假设电解前后溶液的体积不变)
参考答案:(1)左 精铜 右 粗铜 硫酸铜溶液?? Ag、Au 本题解析:考查电化学原理的应用 本题难度:一般 5、填空题 (12分)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。 参考答案:(1)CH4(g)+H2O(g)=CH3OH (g)+H2( 本题解析: 本题难度:困难
(1)粗铜精炼时,粗铜和电源的正价相连,作阳极。纯铜和电源的负极相连,作阴极,电解质溶液是硫酸铜溶液。纯铜中含有的杂质铁和镍的活泼性均强于铜的,所以二者首先失去电子。银和金的活泼性弱于铜的,在铜存在的条件下,二者不可能失去电子,二者最终形成阳极泥。
(2)根据装置图可判断A和电源的负极相连,作阴极,得到电子发生还原反应,电极反应式
为PbSO4+2e-=Pb+SO42-。B和电源的正极相连,作阳极,失去电子发生氧化反应,电极反应式为PbSO4-2e-+ 2H2O =
I:CH4(g)+H2O(g) CO(g) + 3H2(g) △H=+206.0kJ·mol-1
CO(g) + 3H2(g) △H=+206.0kJ·mol-1
II:CO(g)+2H2(g) CH3OH(g) △H=-129.0kJ·mol-1
CH3OH(g) △H=-129.0kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为:
。
(2)将1.0molCH4和2.0molH2O(g)通入容积为10L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如下图。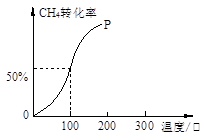
①假设100 ℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1MPa、温度为300℃条件下,将amol CO与3amol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
(填字母序号)。
A c(H2)减少 B 正反应速率加快,逆反应速率减慢
C CH3OH 的物质的量增加 D 重新平衡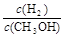 减小
减小
E.平衡常数K增大
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+ 做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程: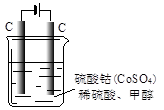
①写出阳极电极反应式 。
②写出除去甲醇的离子方程式 。
试题分析:(1)I:CH4(g)+H2O (g)="CO" (g)+3H2(g)△H=+206.0kJ?mol-1
II:CO(g)+2H2(g)=CH3OH (g)△H=-129.0kJ?mol-1
依据盖斯定律,Ⅰ+Ⅱ得到:CH4(g)+H2O(g)=CH3OH (g)+H2(g))△H=+77kJ?mol-1
(2)将1.0mol CH4和2.0mol H2O ( g )通入容积固定为100L的反应室,在一定条件下发生反应I,由图象可知100℃甲烷转化率为50%,故参加反应的甲烷为1mol×50%=0.5mol,则:
CH4(g)+H2O (g)="CO" (g)+3H2(g)
起始量(mol):1.0 2.0 0 0
变化量(mol):0.5 0.5 0.5 1.5
平衡量(mol):0.5 1.5 0.5 1.5
①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率="1.5mol÷100L÷5min=0.03" mol?L-1?min-1。
②100℃时反应I的平衡浓度为c(CH4)=0.050mol/L,c(H2O)=0.015mol/L,c(CO)=0.005mol/L,c(H2)=0.015mol/L,平衡常数K=0.005×0.0153÷(0.005×0.015)=2.25×10-4。
(3)A.平衡后将容器的容积压缩到原来的1/2,压强增大,平衡向正反应方向移动,生成物的浓度增大,由于平衡常数不变,结合平衡常数可知,平衡时反应物各组分的浓度都增大,故A错误;B.压强增大,正、逆反应速率都增大,但正反应速率增大更多,故B错误;C.压强增大,平衡向正反应方向移动,CH3OH 的物质的量增加,故C正确;D.压强增大,平衡向正反应方向移动,氢气的物质的量减小、甲醇的物质的量增大,故重新平衡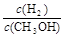 减小,故D正确;E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误。
减小,故D正确;E.平衡常数只受温度影响,温度不变,平衡常数不变,故E错误。
(4)①通电后,将Co2+氧化成Co3+,电解池中阳极失电子发生氧化反应,电极反应为Co2+-e-=Co3+。
②以Co3+做氧化剂把水中的甲醇氧化成CO2而净化,自身被还原为Co2+,结合原子守恒与电荷守恒可知,还原生成H+,配平书写离子方程式为:6Co3++CH3OH+H2O=CO2↑+6Co2++6H+。
考点:本题考查热化学方程式、化学平衡图象、影响化学平衡因素、平衡常数与反应速率计算、原电池。