时间:2017-01-16 17:04:55
1、填空题 (14分)铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=====FeSO4+Cu
上述两种方法中,铜元素均被??????????(填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下: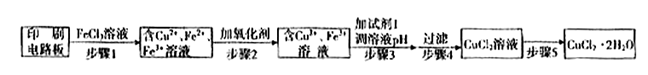 ①证明步骤I所加FeCl3溶液过量的方法是???????????。
①证明步骤I所加FeCl3溶液过量的方法是???????????。
②步骤2中所加的氧化剂最适宜的是??????????。
A.HNO3????????? B.H2O2???????????????????? C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是??????????。(写出一种即可)
④蒸发农缩CuCl2溶液时,要滴加浓盐酸,目的是?????????(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(nq)===CuSO4(aq)+2H2O(l)△H1=-320kJ/mol
又知:2H2O2(l)==2H2O(l)+O2(g)????△H2=-196kJ/mol
H2(g)+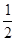 O2(g)==H2O(l)??????????△H3=-286kJ/mol
O2(g)==H2O(l)??????????△H3=-286kJ/mol
则反应Cu(s)+H2SO4(aq)==CuSO4(aq)+H2(g)的△H=?????。
(3)欲实现反应Cu+H2SO2==CuSO4+H2,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)
参考答案:
(1)还原
(2)方法一
①取少量充分反
本题解析:(1)两反应中铜元素化合价均降低,得电子,发生还原反应
(2)①可用KSCN溶液来检验Fe3+的存在来检验FeCl3溶液是否过量:取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量
②为不引入杂质,应选用双氧水,不引入任何杂质:2Fe2++H2O2+2H+=2Fe3++2H2O
③所加物质首先必须消耗H+,并且不能引入任何杂质离子,故可选用铜的氧化物或氢氧化物:CuO或Cu(OH)2
④CuCl2在溶液中可以发生水解反应,CuCl2+2H2
本题难度:一般
2、计算题 (8分)某研究性学习小组拟用铜屑与氧化铜混合物与硫酸和硝酸组成的混酸反应来制取CuSO4·5H2O晶体,混酸中硝酸的还原产物为NO,反应过程中不产生SO2,反应后的溶液中不含Cu(NO3)2, 反应中固体完全溶解,两种酸均恰好完全反应。设固体混合物的总质量为480 g,其中铜屑的质量分数为x,试回答下列。
(1)若x =0.4,混酸中HNO3与H2SO4的物质的量之比为:???????????;
(2)若x =0.4,480g固体混合物与一定量混酸微热后,充分反应,冷却恰好只得到CuSO4·5H2O,试求原混酸中H2SO4的质量分数??????????????。
参考答案:(1)?10 :33 ??(2)? 52.7%
本题解析:(1)n(Cu)= ="3mol??" 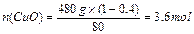
n(H2SO4)="3mol+3.6mol=6.6mol?" n(HNO3)= n(Cu)="2mol"
n(HNO3):n(H2SO4)=" 2mol" :6.6mol =10:33
(2)m(H2SO4)=6.6mol×98g/mol=646.8
本题难度:简单
3、选择题 下列说法错误的是;
A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的CO2
B.硅酸盐NaAlSiO4·nH2O可改写成氧化物形式为:Na2O·Al2O3·2SiO2·2nH2O
C.Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,其硬度比金属Al、Cu、Fe都大
D.过量铁与浓硫酸加热反应可以得到氢气
参考答案:A
本题解析:
试题分析:A.某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为水中溶解了较多的SO2,发生反应:2SO2+2H2O+ O2=2H2SO4;由弱酸变为强酸,溶液中H+浓度增大,所以pH减小。错误。B.硅酸盐既可以用盐的形式表示,也可以用氧化物的形式表示。在用不同的形式表示时,各种元素的原子个数比相同。因此NaAlSiO4·nH2O也可改写成氧化物形式为:Na2O·Al2O3·2SiO2·2nH2O。正确。C. Al65Cu23Fe12是一种拟晶,具有合金的优良物理性能,合金具有许多优
本题难度:一般
4、实验题 某同学将一定量铁粉与Cl2恰好完全反应得到一固体物质R,然后通过实验确定其成分。探究过程如下:
(1)提出假设:(请把下列假设补充完整)
假设A:该固体物质是FeCl3;
假设B:__________________________________________________________;
假设C:__________________________________________________________。
(2)设计实验方案:
取少量固体物质R于烧杯中,加适量水溶解,然后取两份R溶液分别进行实验,实验现象与结论如下表,请在表格内填写实验现象:
| 实验方法 | 实验现象 | 结论 | ||||||||||||
| ①向R溶液中 加KSCN溶液 | ? | 固体物质中有FeCl3 | ||||||||||||
| ②向R溶液中滴加 酸性KMnO4溶液 | ? | 固体物质中不含FeCl2 ? 由此得出结论:假设________成立(填字母)。 (3)写出向R溶液中滴加少量KSCN溶液的离子方程式:????????????????????????????。25°C时,测得该反应达平衡时的平衡常数为K1,保持温度不变,继续滴加少量KSCN溶液,达新平衡时,测得平衡常数为K2,则K1????K2(填“>”,“<”或“=”),溶液的颜色??????(填“变深”,“变浅”或“不变”)。 (4)R溶液常作印刷电路铜板的腐蚀剂,写出该反应的离子方程式:___________________________。 参考答案:(9分,每空1分) 本题解析: 本题难度:一般 5、填空题 (1)向FeCl3溶液中加入a g的铜粉,搅拌使之全部溶解,溶液中一定有的阳离子是_________。可能有的阳离子是???????。发生反应的离子方程式为???????????????????;再向其中加入 b g铁粉,充分反应后过滤得滤渣c g,可能发生反应的离子方程式为????????????????。若已知 a>b>c,则 c克滤渣是_________。
|