时间:2017-01-16 17:01:38
1、选择题 25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是
A.1×10-7mol·L-1
B.1×10-12mol·L-1
C.1×10-2mol·L-1
D.1×10-14mol·L-1
2、简答题 硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:
SO2(g)+2CO(g)=2CO2(g)+1/xSx(s)??△H=akJ/mol
2COS(g)+SO2(g)=2CO2(g)+3/xSx(s)??△H=bkJ/mol。
则COS(g)生成CO(g)与Sx(s)反应的热化学方程式是?????????????????????。
(2)雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料。已知As2S3和HNO3有如下反应:
As2S3+10H++ 10NO3?=2H3AsO4+3S+10NO2↑+ 2H2O,当生成H3AsO4的物质的量
为0.6 mol反应中转移电子的数目为???????,
(3)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如下图所示(忽略滴加过程H2S气体的逸出)。
①B表示?????。
②滴加过程中,溶液中微粒浓度大小关系正确的是??????(填字母)。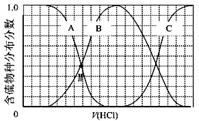 a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
a.c(Na+)= c(H2S)+c(HS?)+2c(S2?)
b.2c(Na+)=c(H2S)+c(HS?)+c(S2?)
c.c(Na+)=3[c(H2S)+c(HS?)+c(S2?)]
③NaHS溶液呈碱性,当滴加盐酸至M点时,溶液中各离子浓度由大到小的顺序为????????????????????????????????????????????????????????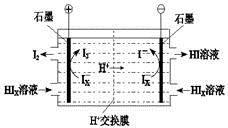 (4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
(4)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示: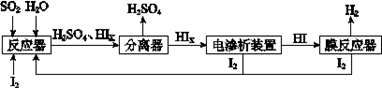
① 写出反应器中发生反应的化学方程式是??????????????????。
② 电渗析装置如右图所示,写出阳极的电极反应式??????????????。该装置中发生的总反应的化学
3、选择题 下列说法正确的是(???)
A.强电解质都是离子化合物,而弱电解质都是共价化合物
B.中和PH值相等、体积相等的盐酸和醋酸,盐酸所消耗的氢氧化钠少
C.将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减小到原来的1/2
D.常温下,PH为12的溶液一定是碱溶液
4、选择题 下列有关叙述中不正确的是
A.某酸式盐NaHY的水溶液显碱性,则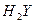 的电离方程式为H2Y H++HY-
的电离方程式为H2Y H++HY-
B.Na2CO3溶液中存在:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3)
C.在由水电离出的c(H+)=lxl0-14m01·L-1的溶液中,可以大量存在Na+、K+、NO3-、HCO3-
D.在常温下,向10mLpH=12的氢氧化钠溶液中加入pH=2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL
5、选择题 常温下,要使0.1mol?L-1醋酸的电离程度和pH都减小,同时又使醋酸根离子浓度增大,可加入的试剂是:(???)
A.CH3COONa浓溶液
B.1mol?L-1氨水
C.1mol?L-1H2SO4
D.2mol?L-1CH3COOH