时间:2017-01-16 16:49:41
1、简答题 由铜片、锌片和50mlCuSO4溶液组成的原电池工作一段时间后,铜片的质量增加了6.4g,且溶液恰好由蓝色变为无色,假设锌片上没有铜单质析出,试计算:
(1)锌片质量减少了______g;
(2)在此过程中通过外电路的电子的物质的量为______;
(3)原CuSO4溶液的物质的量浓度为______.
参考答案:(1)电池反应式为:Cu2++Zn=Zn2++Cu,设参加反
本题解析:
本题难度:一般
2、填空题 某学生试图用电解法根据电极上析出物质的质量来验证阿佛加德罗常数值,其实验方案的要点为:
①?用直流电电解氯化铜溶液,所用仪器如图: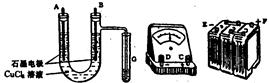
②在电流强度为I安培,通电时间为ts钟后,精确测得某电极上析出的铜的质量为mg。
试回答:
(1)连接这些仪器的正确顺序为(用图中标注仪器接线柱的英文字母表示。下同)E接???,C接???,????接F。
实验线路中的电流方向为???→ ???→???→C→ ?????→???。
(2)写出B电极上发生反应的离子方程式 ???????????????????????????,G试管中淀粉KI溶液变化的现象为??????????,相应的离子方程式是??????????????????????。
(3)为精确测定电极上析出铜的质量,所必需的实验步骤的先后顺序应是?????????。(选填下列操作步骤的编号)
①称量电解前电极的质量
②刮下电解后电极上的铜并清洗
③用蒸馏水清洗电解后电极
④低温烘干电极后称量
⑤低温烘干刮下的铜后称量
⑥再次烘干后称量至恒重
(4)已知电子的电量为1.6×10-19C。试列出阿佛加德罗常数的计算表达式:NA??????????????????。
参考答案:(1)E接D、C接A、B接F;F→B→A→C→D→E
本题解析:本题将物理中电路连接与化学中仪器连接相结合,将电学知识与电解原理相结合,并设置一个利用电解方法来验证阿佛加德罗常数的全新情境,具有一定的深度和灵活性。解题时应将理化相关知识有机融合,方能解决相关问题。
(1)由于U形管右侧有一处理气体的支管,所以可断定B电极为有Cl2生成的一极,即为阳极。显然F应与B连接,A为阴极,结合安培计接入线路的物理知识,A应接C,D接E。
(2)电解CuCl2,阴、阳两极的电极反应式为:
阴极:Cu2++2e=Cu;阳极:2Cl--2e=Cl2↑
生成的C
本题难度:一般
3、选择题 应用电解法制备的物质主要有三种:一是铝的工业制备;二是电解饱和NaCl溶液制备烧碱;三是金属钠的制备.下列关于这三个工业生产的描述中正确的是( )
A.电解法制铝时一般是用熔融态的氧化铝进行电解,但也可用熔融态的A1C13
B.电解法生产铝时,每转移3mol电子的时候,就能生产出1mol的铝
C.在电解饱和NaCl溶液中,电解池中的阴极产生的是H2,NaOH在阳极附近产生
D.电解饱和NaCl溶液和金属钠的冶炼都用到了NaC1,在电解时它们的阴极都是C1-失电子
参考答案:A、电解法制取金属应电解熔融态的金属离子化合物,不能电解熔融
本题解析:
本题难度:一般
4、选择题 已知铅蓄电池放电时发生如下反应:负极:Pb+SO42-
参考答案:
本题解析:
本题难度:一般
5、填空题 (共13分)氯碱工业是最基本的化学工业之一,其主要原理基于电解饱和食盐水:2NaCl+2H2O 2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
2NaOH+H2↑+Cl2↑,它的产品烧碱和氯气以及氢气应用广泛。请回答下列问题:
(1)电解前,如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是______________(填字母代号)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(2)“盐泥”是电解食盐水过程中形成的工业“废料”。某工厂的盐泥组成如下:
| 成分 | NaCl | Mg(OH)2 | CaCO3 | BaSO4 | 其他不溶物 |
| 质量分数(%) | 15~20 | 15~20 | 5~10 | 30~40 | 10~15 利用盐泥生产MgSO4·7H2O晶体的工艺流程如下图所示。 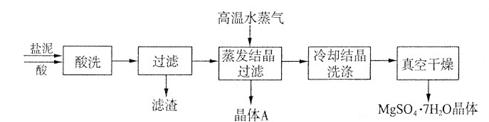 回答下列问题: ①酸洗过程中加入适量硫酸控制pH为5左右,反应温度在50℃左右。持续搅拌使之充分反应,以使Mg(OH)2充分溶解并转化为MgSO4,CaCO3在此过程中转化为CaSO4,请解释此转化得以发生的原因_________。 ②过滤所得滤渣的主要成分为____________________________。 ③根据下图分析,蒸发结晶过滤所得晶体A主要成分为____________________。 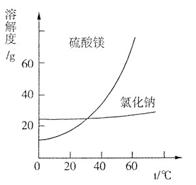 ④真空干燥MgSO4·7H2O晶体的原因是______________________。 (3)已知NaCl在60 ℃的溶解度为37.1 g,现电解60 ℃精制饱和食盐水1371 g,经分析,电解后溶液密度为1.37 g·cm-3,其中含有20 g NaCl,则电解后NaOH的物质的量浓度为________________mol/L。 参考答案:(1)A、C 本题解析: 本题难度:一般 |