时间:2017-01-16 16:43:47
1、简答题 【化学与技术】
下图表示某些化工生产的流程(有的反应条件和产物已略去)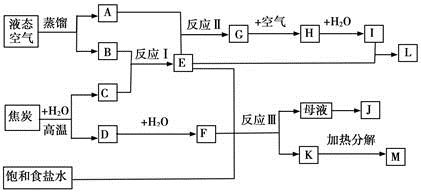
请回答下列问题:
(1)流程中所涉及的化学工业????????????????????(写出两个即可)。
(2)反应I需在500℃进行,主要原因是??????????;实际工业生产中,反应Ⅱ的条件是????。
(3)写出反应III的化学方程式?????????????????????????。
(4)工业上,析出K后,再向母液中继续通入E,并加入细小食盐颗料,其目的是?????。
(5)工业上常用Na2CO3溶液吸收制取HNO3产生的尾气中的NO2,生成NaNO3、NaNO2和一种气体,写出反应的化学方程式??????????????。
参考答案:(1)合成氨,氨氧化法制硝酸,联合制碱法(或侯氏制减法) 本题解析:依据流程分析液态空气蒸馏得到氧气和氮气,焦炭和水蒸气反应生成氢气和一氧化碳;推断反应Ⅰ是合成氨的反应,所以A为O2、B为N2、C为H2、E为NH3,反应Ⅱ是氨气的催化氧化反应生成G为NO,H为NO2、I为HNO3,L为NH4NO3,D为CO,F为CO2;E+F+饱和食盐水=NaHCO3↓+NH4Cl,Ⅲ反应是工业侯德榜制碱法;K为NaHCO3,M为Na2CO3;J为NH4Cl; 本题难度:一般 2、填空题 (13分)以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为: 参考答案:(1)非氧化还原反应 本题解析:(1)根据方程式可看出,反应前后元素的化合价均没有方式变化,所以是非氧化还原反应。 本题难度:简单 3、填空题 化工生产中涉及较多的化学原理、生产方法和工艺流程,请回答下列问题: 参考答案:(每空1分,8分)(1)沸腾炉、接触室、吸收塔?(2)d?( 本题解析: 4、填空题 (12分)合成氨生产技术的创立开辟了人工固氮的途径,对化学工业技术也产生了重大影响。合成氨反应的化学方程式为:N2(g)+3H2(g) 参考答案:(1)否(不能)。(2分) 本题解析:略 本题难度:简单 5、选择题 下列工业生产中,关系式不正确的是……( ) 参考答案:C 本题解析:利用守恒法考虑,首先要清楚工业生产这几种物质的反应原理。C中:C+2H2O=CO2+2H2,N2+3H2=2NH3,故C---2H2---4/3NH3 本题难度:一般
(1)流程分析推断反应Ⅰ是工业合成氨;Ⅱ是工业上制硝酸的第一步氨气的催化氧化;Ⅲ是工业上候氏制碱法或联合制碱法;
(
FeTiO3+2H2SO4===TiOSO4+FeSO4+2H2O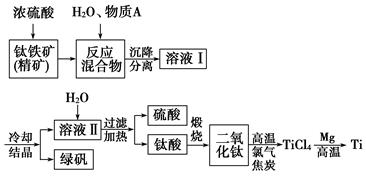
回答下列问题:
(1)钛铁矿和浓硫酸反应属于________(选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是
_________________________,?????????????????????
(3)反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是__________________
2MgCl2+Ti在Ar气氛中进行的理由是__________________
________________________________________________________________________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH1=-72 kJ·mol-1
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) ΔH2=38.8 kJ·mol-1
C(s)+CO2(g)===2CO(g) ΔH3=282.8 kJ·mol-1
反应C(s)+O2(g)===CO2(g)的ΔH=________。
(2)Fe 绿矾、硫酸
(
(2)为反止Fe2+被氧化,且又不能引入杂质,A只能是铁。根据转化关系图可得硫酸和绿矾,硫酸可以回收利用,绿矾属于副产物。
(3)镁属于活泼金属,在加热时易被空气氧化。
(4)考查盖斯定律的应用。前2个反应相减得到2C(s)+O2(g)==="2CO" (g)??? ΔH=-110.8 kJ·mol-1。根据C(s)+CO2(g)===2CO(g) ΔH3=+282.8 kJ·
(1)工业上用硫铁矿生产硫酸的主要设备有__________、__________、__________。
(2)工业上制备硫酸,常采用__________(填编号)为吸收剂,以高效吸收三氧化硫。
a.自来水??????????? b.蒸馏水??????????? c.稀硫酸??????? d.98.3%硫酸
(3)侯氏制碱法中,用二氧化碳和氨气与饱和食盐水反应制碳酸氢钠,应先向饱和食盐水中通入_____。
(4)石油裂化分为热裂化、催化裂化和_______,其目的为__________________。
(5)为降低电解液熔点,工业上生产铝时需要加入的熔剂为____________________。
试题分析:(1)工业上制硫酸的主要反应如下,在沸腾炉中反应:4FeS2+11O2 2Fe2O3+8SO2;在接触室内反应:2SO2+O2
2Fe2O3+8SO2;在接触室内反应:2SO2+O2 本题难度:一般
本题难度:一般
 3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
3NH3(g) △H=-92.2kJ/mol。合成氨工业中原料气N2可从空气中分离得到,H2可用碳在高温下与水蒸气反应制得。我国合成氨工业目前的生产条件为:催化剂-铁触媒,温度-400~500℃,压强-30~50MPa。回答下列问题:
(1)将水蒸气通过红热的炭即产生水煤气:
C(s) + H2O(g) 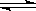 ?H2(g) + CO(g)??△H =" +131.3" kJ ,△S =" +133.7" J/K
?H2(g) + CO(g)??△H =" +131.3" kJ ,△S =" +133.7" J/K
该反应在低温下能否自发????????????????????(填:能或否)。
(2)合成氨工业中原料气压缩到30~50MPa的原因是????????????????????????????????。从平衡移动原理分析,低温有利于原料气的转化,实际生产中采用400~500℃的高温,原因之一是考虑到催化剂的催化活性,原因之二是????????????????????????????????????????。
(3)已知在400℃时,N2 (g)+ 3H2(g)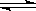 2NH3(g) 的K=0.5。
2NH3(g) 的K=0.5。
①在400℃时, 2NH3(g) N2 (g)+ 3H2(g)的K=????????????(填数值)。
N2 (g)+ 3H2(g)的K=????????????(填数值)。
②400℃时,在0.5L的反应容器中进行合成氨反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应V(N2)正????????????V(N2)逆(填:>、<、=、不能确定)。
③500℃、50MPa时,在容积为2L的容器中加入1?mol?N2、3mol?H2,反应达平衡后测得平衡常数为K,此时N2的转化率为x。则K和x的关系满足K=??????????????????。
④在三个相同容器中各充入1 molN2和3molH2,在某一不同条件下反应并达到平衡,氨的体积分数随时间变化曲线如下图。下列说法正确的是???????????(填序号)。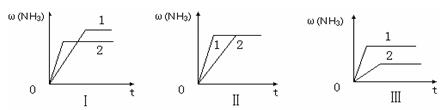
A.图Ⅰ可能是不同压强对反应的影响,且P2>P1
B.图Ⅱ可能是不同压强对反应的影响,且P1>P2
C.图Ⅲ可能是不同温度对反应的影响,且T1>T2
D.图Ⅱ可能是同温同压下,催化剂性能:1>2
(2)增大压强,使合成氨的
A.合成漂白粉:2Cl2---Ca(ClO)2
B.合成H2SO4:FeS2---2H2SO4
C.合成氨:C---H2---2/3 NH3
D.合成HNO3:3NH3---3HNO3