时间:2017-01-16 16:26:42
1、填空题 二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
(1)硫酸生产中,SO2催化氧化生成SO3: 2SO2(g)+O2(g) 2SO3(g) 某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。
2SO3(g) 某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如图所示。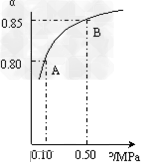
根据图示回答下列问题:
①将2.0mol?SO2和1.0mol?O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10MPa。该反应的平衡常数表达式为:__________;等于____________。
②平衡状态由A变到B时.平衡常数K(A)_______K(B)(填“>”、“<”或“=”)。
(2)用CH4催化还原NOx可以消除氮氧化物的污染。
例如:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)????△H=-574?kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)?????△H=-1160?kJ·mol-1
若用标准状况下4.48L?CH4还原NO2至N2整个过程中转移的电子总数为______(阿伏加德罗常数的值用NA表示),放出的热量为______kJ。
(3)新型纳米材料氧缺位铁酸盐(MFe2Ox?3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示: 请写出MFe2Ox分解SO2的化学方程式___________(不必配平)。 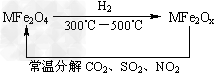
2、选择题 已知下列反应的热化学方程式为:
(1)C(s)+O2(g)=CO2(g) △H1= -393.5kj/mol
(2)CH3COOH(1) +2O2 (g) =2CO2(g)+2H2O(l) △H2=-870.3kj/mol
(3)H2(g)+1/2O2(g)=H2O(1) △H3= -285.8kj/mol
2C(s)+2H2(g)+O2(g)= CH3COOH(l)的反应热(焓变)为 [???? ]
A.488.3 kJ/mol
B.-488.3 kJ/mol
C.-244.15 kJ/mol
D.244.15 kJ/mol
3、简答题 在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH4,CH4在光照下可与Cl2反应,也可以用CH4和H2O为原料制备二甲醚和甲醇等新型燃料.
(1)CH4可与Cl2反应,其反应机理如下:
(2)Cl2→2Cl2△H=+243kJ?mol-1
①Cl2→2Cl????△H=+243KJ??mol-1
②Cl+CH4→CH3+HCl???△H=+4KJ?mol-1
③CH3+Cl2→CH3Cl+Cl????△H=-106KJ?mol-1
则CH4与Cl2反应生成CH3Cl(g)的热化学方程式为:
(2)在一定条件下,发生反应:CH4(g)+H2O(g)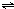
ClO(g)+3H2(g)△H>0.
在其它条件不变的情况下降低温度,逆反应速率将______(填“增大”、“减小”或“不变”).若在2L密闭容器中发生反应,T℃时,通入2mol?CH4(g)和2mol?H2O(g),反应达平衡后,生成l?mol?CO,此时向容器中同时加入1mol?CO和3molH2的混合气体(保持温度不变),则平衡将______(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡后平衡常数______
(3)CH4(g)和H2O(g)生成的CO和H2在一定条件下可发生反应CO(g)+2H2(g)
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有______.(选填序号).
a.再充入1mol?H2??b.使用健化剂??c.再充入2mol?CO??d.升高温度
(4)CH4可用于设计燃料电池,甲烷燃料电池的工作原理如下图所示: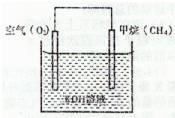
?????
?则正极的电极反应式为:______;
反应一段时间后溶液的pH______(填“升高”、“降低”或“不变”).
4、选择题 已知H2 (g)+Br2 (1)= 2HBr(g);△H= -72 kJ/mol,蒸发1mol Br2(1)需要吸收的能量为30 kJ,其他相关数据如下表: 则表中a为 [???? ]
[???? ]
A.404
B.260
C.230
D.200
5、选择题 已知:
(1)如图
(2)25℃、101kPa下:
①2Na?(s)+
| 1 2 O2(g)═Na2O(s)△H1=-414kJ/mol ②2Na(s)+O2(g)═Na2O2(s)△H2=-511kJ/mol 根据以上信息判断,下列说法正确的是( ) A.CO的燃烧热为283?kJ B.常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快 C.25℃、101?kPa下,Na2O2(s)+2Na(s)═2Na2O(s)??H=-317?kJ/mol D.Na2O?和Na2O2阴阳离子个数比不相等  |