时间:2017-01-16 16:20:46
1、填空题 某工厂用软锰矿(含MnO2约70%及少量Al2O3)和闪锌矿(古ZnS约80%及少量FeS)共同生产MnO2和Zn(干电池原料)生产工艺如下:
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液.
②IV中的电解反应式为:MnSO4+ZnSO4+2H2O═MnO2+Zn+2H2SO4
(1)A中属于还原产物的是______.
(2)Ⅱ中加入MnCO3、Zn2(OH)2CO3的作用是______;
Ⅱ需要加热的原因是______;C的化学式是______.
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是______.
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工原料是______.
(5)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是______.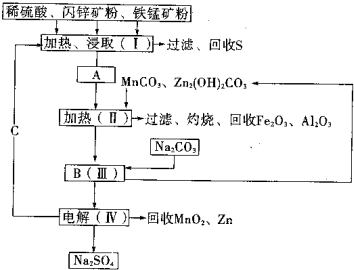
参考答案:(1)比较信息①,A与软锰矿中元素化合价的变化可知,锰元素化
本题解析:
本题难度:一般
2、填空题 按下图所示装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为__________________,B池为________________________。
(2)铁极为_________极,电极反应式为________________________;铜极为________极,电极反应式为________________________ ;石墨棒C1为_______极,电极反应式为____________________________;石墨棒C2附近发生的实验现象为________,反应结束后,B池溶液的pH值________。(增大、减小、不变,忽略气体溶于水)
(3)当C2极析出224 mL气体(标准状况下),铁的质量________(增加或减少)__________g
参考答案:(1)原电池(1分)?电解池(1分)
(2)负极(1分
本题解析:
试题分析:(1)A池可发生自发的氧化还原反应,为原电池。B池为电解池。(2)A池中铁比铜活泼,铁作负极,Fe-2e-=Fe2+?铜作正极,Cu2++2e-=Cu,在B池中石墨棒C1与电源正极相连,作阳极,2Cl--2e-=Cl2,石墨棒C2作阴极,2H2O -2e-=H2 + 2OH-???(3)C2产生H2224mL,物质的量为0.01mol,转移0.02mol电子,应反应0.01mol铁,质量为0.56g.
本题难度:一般
3、填空题 (10分)工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g) 2NH3(g)回答下列问题:
2NH3(g)回答下列问题:
(1)已知:N2(g)+O2(g)=2NO(g);△H=+180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g); △H=-905kJ/mol
2H2(g)+O2(g)=2H2O( g);?? △H=-483.6kJ/mol
g);?? △H=-483.6kJ/mol
则N2(g)+3H2(g) 2NH3(g)的△H=_______________。
2NH3(g)的△H=_______________。
(2)(NH4)2SO3和NH4HSO4是两种化工原料。
①对于(NH4)2SO3溶液,某同学写出了如下的正确关系式:
2[c(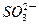 )+c(
)+c(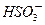 )+c(H2SO3)]=c(
)+c(H2SO3)]=c( )+c(NH3·H2O)
)+c(NH3·H2O)
该同学的依据是:_________________________________________
⑦写出NH4HSO4溶液中离子浓度由大到小的顺序:______________________。
(3)甲烷——空气燃料电池是一种碱性燃料电池,电解质溶液是20%-30%的KOH溶液。现用甲烷——空气燃料电池进行下图所示实验(其中a、b均为碳棒):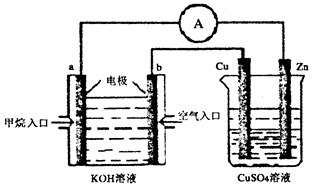
①Zn片上发生的电极反应式:_____________________。
②a电极的电极反应式_______________________________。
参考答案:本题解析:略
本题难度:一般
4、选择题 下列现象与电化学腐蚀无关的是( )
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.生铁比软铁心(几乎是纯铁)容易生锈
C.铁制器件附有铜质配件,在接触处易生锈
D.银质奖牌在空气中久置后表面变暗
参考答案:A、铜锌合金在电解质溶液中形成原电池反应,锌做负极被腐蚀.正
本题解析:
本题难度:一般
5、选择题 已知蓄电池在放电时起原电池的作用,充电时起电解池的作用。铅蓄电池在放电和充电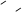 时发生的化学反应可用下式表示:
时发生的化学反应可用下式表示: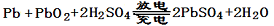
据此判断下列叙述中正确的是?? (??? )
A.放电时正极电极反应式PbO2 + SO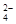 + 2e – + 4 H+= PbSO4 + 2H2O
+ 2e – + 4 H+= PbSO4 + 2H2O
B.充电时蓄电池负极应与电源正极相连接
C.充电时,若要使1mol PbSO4转变为PbO2,则需要通过4mol电子
D.电池放电时,溶液酸性增强
参考答案:A
本题解析:
试题分析:原电池中正极得到电子,发生还原反应。负极失去电子,发生氧化反应。放电相当于原电池,充电相当于电解池,所以根据总的反应方程式可知,A正确,D不正确,酸性是降低的;B不正确,充电时蓄电池负极应与电源负极相连接;C不正确,充电时,若要使1mol PbSO4转变为PbO2,则需要通过2mol电子,答案选A。
点评:准确判断原电池中正负极和电解池中的阴阳极是判断电极反应式和电极产物的关键。
本题难度:一般