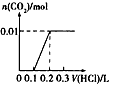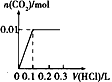1、选择题 将0.4gNaOH和l.06gNa2CO3混合并配成溶液,向溶液中滴加0.l moI·L-1稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是[???? ]
A.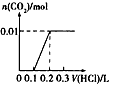
B.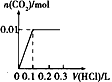
C.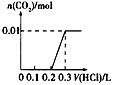
D.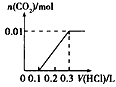
2、实验题 25℃时,某化学兴趣小组在测定酸碱中和滴定曲线的活动中,从实验室领取一瓶一元酸(HA)和一瓶pH=11 的碱(BOH)溶液。由于标签破损不知道是何种酸,经测得该酸溶液的pH=3。为了进一步认识该酸,请你参与该兴趣小组同学设计的实验方案。
(1)证明该一元酸是不是盐酸。(简要写出所用试剂、步骤及现象和结论)____。
(2)探究HA是强酸还是弱酸:取上述HA和BOH的溶液各20mL混合后溶液的pH=5,试推测HA是强酸还是弱酸。你的结论是___,理由是____。
(3)若HA是强酸、BOH是强碱,现将此HA溶液和BOH溶液按一定体积比混合后测得溶液的pH=4(设混合后溶液的体积变化忽略不计)。则混合时酸和碱的体积之比为V(HA):V(BOH)=____。
3、简答题 由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化3MnO2+KClO3+6KOH
熔融
.
3K2MnO4+KCl+3H2O
加酸歧化3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
| K2CO3 | KHCO3 | K2SO4 | KMnO4
溶解度/g
111
33.7
11.1
6.34
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和______.(填字母)
a.表面皿b.蒸发皿c.铁坩埚d.泥三角
(2)加酸时不宜用硫酸的原因是______;不宜用盐酸的原因是______.
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O通电
.
2KMnO4+2KOH+H2↑.与原方法相比,电解法的优势为______.
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ称取0.80g左右的高锰酸钾产品,配成50mL溶液.
Ⅱ准确称取0.2014g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化.
Ⅲ将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点.记录消耗高锰酸钾溶液的体积,计算得出产品纯度.
①滴定过程中反应的离子方程式为______.
②达到滴定终点的标志为______.
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度______.(填“偏高”、“偏低”或“无影响”)
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为______.

4、选择题 在室温下进行中和滴定,下列有关说法正确的是( ) A.参加反应的酸和碱的物质的量相等
B.滴定时,应时刻注视滴定管中液面的变化
C.pH=7时,参加反应的酸中的H+总量和碱中OH-总量相等
D.酸和碱恰好完全反应时,反应的热效应即为中和热
5、实验题 某学生用物质的量的浓度为amol/L的标准NaOH去测定VmL HCl溶液的物质的量浓度。回答下列问题: (1)实验前应先检查滴定管__________________,实验过程中眼睛__________________;
(2)其操作可分解为如下几步:
A.取V/4 mL待测盐酸溶液注入洁净的锥形瓶中,并加入2~3滴酚酞试液;
B.用标准氢氧化钠溶液润洗滴定管2~3次;
C.把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液;
D.取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处;
E.调节液面至“0”至“0”刻度以下,记下读数;
F.把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并主下滴定管的读数;
正确的操作顺序是:___ 、D 、 _____ 、 _____、 A、____ ;
(3)滴定至终点时的现象是:_____________________
(4)下图是碱式滴定管中液面在滴定前后的读数
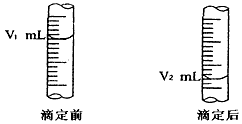
c (HCl) =__________________
(5)下列操作会使测定的HCl物质的量浓度偏大的是________________
A、滴定前碱式滴定管尖嘴部分留有气泡,滴定后滴定管尖嘴部分气泡消失;
B、滴定终点后溶液颜色迅速消失;
C、滴定前仰视,滴定终了平视;
D、实验前先用待测液润洗锥形瓶;
E、碱式滴定管用蒸馏水洗净后,未用标准溶液润洗,使滴定结果;
微信搜索关注"91考试网"公众号,领30元,获取公务员事业编教师考试资料40G
|
|
|