时间:2017-01-16 16:03:59
1、选择题 下列各试剂中,不能用来鉴别Fe2+溶液和Fe3+溶液的是
A.NaOH?溶液
B.盐酸
C.NH4SCN?溶液
D.KSCN溶液
参考答案:B
本题解析:分析:三价铁离子的检验方法为:取待测液于试管中,向待测溶液中加入KSCN溶液,溶液立刻变成红色说明溶液中有Fe3+,即Fe3++3SCN-?Fe(SCN)3;根据常见离子的颜色判断Fe3+(黄色);Fe3+与OH-反应生成红褐色Fe(OH)3;
二价铁离子的检验方法为:再取待测液于试管中,加KSCN溶液没有明显现象,加入氯水溶液变成红色,说明溶液只有Fe2+;根据常见离子的颜色判断Fe2+(浅绿色);向Fe2+溶液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色;据此即可解答.
解答:A.向Fe2+溶液中加入NaOH溶液后,Fe2+与OH-反应生成Fe(OH)2,Fe2++2OH-=Fe(OH)2↓,Fe(OH)2不稳定易被氧气氧化为Fe(OH)3,4Fe(OH)2+O2+2H2O=4Fe(OH)3,白色的Fe(OH)2沉淀变成红褐色Fe(OH)3,向Fe2+溶液中加入NaOH溶液后,观察到生成的白色沉淀迅速变成灰绿色,最后变成红褐色;Fe3+与OH-反应Fe3++3OH-=Fe(OH)3↓,生成红褐色Fe(OH)3,两者反应现象不同,故A正确;
B.盐酸和分Fe2+和Fe3+不反应,不能区别Fe2+和Fe3+,故B错误;
C.加入NH4SCN溶液,发生络合反应,Fe3++3SCN-?Fe(SCN)3溶液立即呈血红色,证明含有三价铁离子;加NH4SCN溶液没有明显现象加入氯水溶液变成红色,说明溶液只有Fe2+,故C正确;
D.加入KSCN溶液,发生络合反应,Fe3++3SCN-?Fe(SCN)3溶液立即呈血红色,证明含有三价铁离子;加KSCN溶液没有明显现象加入氯水溶液变成红色,说明溶液只有Fe2+,故D正确;
故选B.
点评:本题考查了二价铁离子和三价铁离子的实验检验方法的应用,根据离子检验产生特征现象进行判断是解答的关键,题目较简单.
本题难度:困难
2、选择题 莽草酸是一种合成治疗禽流感药物达菲的原料,鞣酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是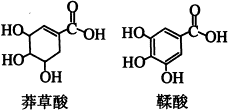
A.鞣酸分子与莽草酸分子相比多了两个碳碳双键
B.等物质的量的两种酸与足量金属钠反应产生氢气的量相同
C.两种酸都能与溴水发生取代反应
D.两种酸遇三氯化铁溶液都显色
参考答案:B
本题解析:试题分析:A、苯环中没有碳碳双键,是一种介于双键和单键之间的特殊键,故A错误;
B、羟基、羧基均能和钠反应放出氢气,并且1mol的羟基和1mol的羧基于钠反应产生的氢气量相等,故B正确;
C、莽草酸中含有碳碳双键,可以和溴水发生加成反应;鞣酸中含有酚羟基,所以鞣酸中苯环上酚羟基邻对位的氢原子能被溴原子取代而发生化学反应,故D错误;
D、莽草酸中不含苯环,无酚羟基,遇三氯化铁溶液不会发生显色反应,故D错误。
故选B。
考点:有机物分子中的官能团及其结构
点评:在有机物中,官能团决定有机物的化学性质,学生要熟记官能团具有的化学性质,并会熟练运用。
本题难度:简单
3、选择题 由氨气、甲烷、氢气组成的混合气体,测得该混合气体的平均相对分子质量为10,则混合气体中氨气、甲烷、氢气的体积比是
A.3∶2∶1
B.1∶2∶3
C.1∶3∶4
D.2∶3∶4
参考答案:D
本题解析:本题混合气体的平均相对分子质量为偶数,而甲烷和氢气的相对分子质量也为偶数,氨气的相对分子质量为奇数,因此混合时只能取氨气的体积比为偶数时才能使平均相对分子质量为偶数.
本题难度:简单
4、选择题 在反应2NH3+3Cl2═6HCl+N2中,氧化剂和还原剂的物质的量之比为
A.1:3
B.1:2
C.2:3
D.3:2
参考答案:D
本题解析:分析:在2NH3+3Cl2=6HCl+N2反应中,氯气中氯元素化合价由0价降低为-1价,氯元素被还原,氯气是氧化剂;氨气中氮元素化合价由-3价升高为0价,氮元素被氧化,氨气是还原剂,根据方程式可知,氯气全部被还原,氨气全部为氧化,根据方程式化学计量数判断氧化剂和还原剂的物质的量之比.据此解答.
解答:在2NH3+3Cl2=6HCl+N2反应中,氯气中氯元素化合价由0价降低为-1价,氯元素被还原,氯气是氧化剂;氨气中氮元素化合价由-3价升高为0价,氮元素被氧化,氨气是还原剂.根据方程式可知,氯气全部被还原,氨气全部为氧化,根据方程式化学计量数可知氧化剂和还原剂的物质的量之比为3:2.
故选D.
点评:本题考查氧化还原反应概念及计算,难度不大 ,判断氧化剂、还原剂后,可以根据电子转移守恒计算氧化剂和还原剂的物质的量之比.
本题难度:简单
5、选择题 在BaCl2溶液中通入SO2气体,溶液仍澄清;若将上述通入SO2气体的BaCl2溶液分盛两支试管,一支加硝酸,另一支加烧碱溶液,结果两支试管都有白色沉淀.由此得出的下列结论合理的是
A.氯化钡有两性
B.两支试管中产生的沉淀均是亚硫酸钡
C.SO2有还原性且水溶液呈酸性
D.增强碱性使SO2水溶液中SO32-浓度增大
参考答案:CD
本题解析:分析:依据复分解反应的条件判断反应能否进行,根据题干中的条件,注意物质的变化,分析现象得出解决的方法;
解答:在BaCl2溶液中通入SO2气体不反应,将上述通入SO2气体的BaCl2溶液分盛两支试管,一支加硝酸,另一支加烧碱溶液,加硝酸的试管中硝酸会氧化二氧化硫为硫酸,故能生成白色沉淀,加烧碱溶液,二氧化硫会与氢氧化钠反应生成亚硫酸盐,与氯化钡会生成亚硫酸钡白色沉淀;
A、氯化钡是强酸强碱盐,不是两性,故A错误;
B、加硝酸的试管生成的是硫酸钡,加烧碱的试管生成的是亚硫酸钡,故B错误;
C、二氧化硫被硝酸氧化说明具有还原性易被氧化,与碱反应说明溶于水生成亚硫酸呈酸性,故C正确;
D、增强碱性会使二氧化硫转化为亚硫酸盐,使亚硫酸根离子浓度增大,故D正确;
故选CD.
点评:本题考查了二氧化硫的化学性质,反应类型和条件.
本题难度:简单