时间:2017-01-16 16:02:01
1、选择题 在反应:2H2S+SO2=3S↓+2H2O中,被氧化与被还原的硫原子数之比( )
A.1:1
B.1:2
C.3:2
D.2:1
参考答案:D
本题解析:
本题难度:简单
2、填空题 常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图I、II所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算
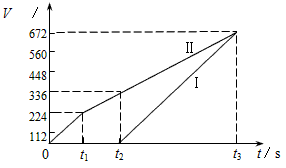
参考答案:(1)本题解析:
本题难度:一般
3、选择题 在反应3Cl2+6KOH=5KCl+KClO3+3H2O中,当有0.5mol电子转移时,参加反应的还原剂的物质的量为[???? ]
A.0.25mol
B.0.5mol
C.0.3mol
D.0.05mol
参考答案:D
本题解析:
本题难度:简单
4、选择题 在反应3BrF3+5H2O=HBrO3+9HF+Br2+O2↑,若有0.3molH2O被氧化,则被水还原的BrF3的物质的量是
A.0.15mol
B.0.2mol
C.0.3mol
D.0.4mol
参考答案:B
本题解析:
本题难度:简单
5、选择题 已知氢化钠(NaH)可与水反应生成氢氧化钠和氢气.有关此反应说法不正确的是
A.氢化钠是还原剂
B.氢气既是氧化产物又是还原产物
C.此反应是氧化还原反应
D.氧化剂与还原剂的质量比为1∶1
参考答案:D
本题解析:
本题难度:简单