时间:2017-01-16 15:53:06
1、选择题 NH4Cl中不存在的键是( )?
A.配位键
B.离子键?
C.极性共价键
D.非极性共价键
2、选择题 北京大学和中国科学院的化学工作者最近研制出碱金属与C60形成的球碳盐K3C60, 实验测知该物质属于离子晶体,且有良好的超导性,下列K3C60的组成和结构分析正确的是(????)
A.该物质分子式为K3C60
B.K3C60的摩尔质量是837
C.1molK3C60中含有的离子键的数目为63×6.02×1023个
D.K3C60中既有离子键 ,又有共价键 ,在熔融状态下能导电
3、选择题 下列关于研究物质性质的基本程序:
①实验和观察;
②观察物质的外观性质;
③解释及结论;
④预测物质的性质.
排列顺序正确的是( )
A.②④①③
B.②①④③
C.②①③④
D.①②③④
4、选择题 下列物质中,既含离子键又含共价键的是( )
A.Na2O
B.NH3
C.Ca(OH)2
D.CaBr2
5、填空题 (14分)现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
| A元素原子的核外p电子总数比s电子总数少1 |
| B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期 |
| C原子核外所有p轨道全满或半满 |
| D元素的主族序数与周期数的差为4 |
| E是前四周期中电负性最小的元素 |
| F在周期表的第七列 (1)A基态原子中能量最高的电子,其电子云在空间有????????个方向,原子轨道呈???????形。 (2)某同学根据上述信息,所画的B电子排布图如图 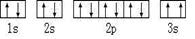 ,违背了??原理。 ,违背了??原理。(3)F位于??????????族??????区,其基态原子有?????种运动状态。 (4)CD3 中心原子的杂化方式为?????,用价层电子对互斥理论推测其分子空间构型为????????,检验E元素的方法是???????????????。 (5)若某金属单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所示。则晶胞中该原子的配位数为???????,该单质晶体中原子的堆积方式为四种基本堆积方式中的??????。若已知该金属的原子半径为d cm,NA代表阿伏加德罗常数,金属的相对原子质量为M,则该晶体的密度为______g·cm-3(用字母表示)。 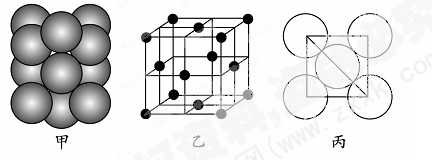 |