时间:2017-01-16 15:47:49
1、选择题 下列液体均处于25℃,有关叙述正确的是 [???? ]
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4的NH4Cl溶液,溶液中c(H+)>c(OH-),且c(H+)/c(OH-)=1×106
C.AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度相同
D.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
参考答案:B
本题解析:
本题难度:一般
2、填空题 (6分)(1)硫化钠水溶液显碱性的原因_______________(用离子方程式表示)
(2)用硫化亚铁作沉淀剂除去污水中的Cu2+_______________________
(3)浑浊的石灰水中存在的溶解平衡________________
参考答案:(1)S2-+H2O本题解析:
试题分析:(1) 硫化钠是强碱弱酸盐,水解显碱性,水解离子方程式为S2-+H2O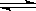 HS-+OH-(2)根据沉淀转化原理:溶解度小的可以转化为溶解度更小的沉淀,方程式为:Cu2++FeS= CuS+Fe2+(3)Ca(OH)2是微溶物,存在的溶解得平衡是:Ca(OH)2(S)
HS-+OH-(2)根据沉淀转化原理:溶解度小的可以转化为溶解度更小的沉淀,方程式为:Cu2++FeS= CuS+Fe2+(3)Ca(OH)2是微溶物,存在的溶解得平衡是:Ca(OH)2(S)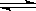 Ca2+ (aq)+2OH-(aq)
Ca2+ (aq)+2OH-(aq)
考点:水解,溶解平衡方程式的书写。
本题难度:一般
3、填空题 (4分)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸的黑色固体。向
AgCI和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体:
(1)写出白色固体转化成黑色固体的化学方程式:???????? ▲??????????????。
(2)白色固体转化成黑色固体的原因是:??????????????? ▲???????????????。
参考答案:本题解析:略
本题难度:简单
4、选择题 已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13 ,Ksp(Ag2CrO4)=9×10-11。某溶液中含有Cl-、Br-和CrO42-,浓度均为0.010mol/L,向该溶液中逐滴加入0.010mol/L的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为
A.Cl-、Br-、CrO42-
B.CrO42-、Br、Cl-
C.Br-、Cl-、CrO42-
D.Br、CrO42-、Cl-
参考答案:C
本题解析:设Cl-、Br-、CrO42-刚开始沉淀时,银离子的浓度分别为x mol、y mol、z mol,则根据Ksp可得:
0.01x=1.56×10-10
0.01y=7.7×10-13
0.01z2=9×10-11
可分别解出x≈1.56×10-8? y≈7.7×10-13? z≈3××10-4.5
可知y<x<z,开始沉淀时所需要的银离子浓度越小,则越先沉淀,因此答案为C
本题难度:一般
5、填空题 (14分)某工业原料主要成分是NH4Cl、FeCl3和AlCl3。利用此原料可以得到多种工业产品。分析下面流程,回答问题。
已知:Ksp[Fe(OH)3]=4.0×10-38
(1)用稀硫酸中和等体积等pH值的氨水和烧碱溶液,前者需要消耗的酸液体积 (填“大”“小”或“相同”)
(2)计算溶液②中Fe3+的物质的量浓度为 mol/L
(3)缓冲溶液中存在的平衡体系有: 、 、
此时溶液中c(NH4+) c(Cl-)(填>、=、<)。
(4)在缓冲溶液中加入少量盐酸或者NaOH溶液,溶液的pH值几乎依然为9.2。简述原理:
请举出另一种缓冲溶液的例子(写化学式) 。
(5)常温下向较浓的溶液④中不断通入HCl气体,可析出大量AlCl3·6H2O晶体,结合化学平衡移动原理解释析出晶体的原因: 。
参考答案:(1)大 &#
本题解析:
试题分析:(1)pH相同的氨水和烧碱,氨水的物质的量浓度大,所以需要的酸的体积大。(2) 溶液的pH=8,氢离子浓度=10-8mol/L,氢氧根离子浓度=10-6mol/L,根据Ksp[Fe(OH)3]=4.0×10-38计算铁离子浓度=4.0×10-20。
(3)缓冲溶液中有铵根离子,所以存在铵根离子的水解平衡,NH4++H2O NH3·H2O+H+,溶液中有一水合氨,NH3·H2O
NH3·H2O+H+,溶液中有一水合氨,NH3·H2O NH4++OH-,存在一水合氨的电离平衡,溶液中肯定存在水的电离平衡, H2O
NH4++OH-,存在一水合氨的电离平衡,溶液中肯定存在水的电离平衡, H2O H++OH-。由于溶液中的pH=9.2,所以溶液显碱性,说明氢离子浓度小于氢氧根离子浓度,根据电荷守恒,所以铵根离子浓度大于氯离子浓度。(4)缓冲溶液中加入少量盐酸,平衡体系(Ⅱ)产生的OH-与酸反应,消耗了加入的H+,当加入少量碱时,平衡体系(Ⅰ)的NH4+与碱反应,消耗了加入的OH-,从而可在一定范围内维持溶液pH大致不变。类似的缓冲溶液由CH3COONa-CH3COOH。 (5) 沉淀①为氢氧化铝和氢氧化铁,加入过量氢氧化钠后溶液③为偏铝酸钠,沉淀②为氢氧化铁沉淀,溶液③中加入足量的盐酸,得到的溶液④为氯化铝溶液,在AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s)
H++OH-。由于溶液中的pH=9.2,所以溶液显碱性,说明氢离子浓度小于氢氧根离子浓度,根据电荷守恒,所以铵根离子浓度大于氯离子浓度。(4)缓冲溶液中加入少量盐酸,平衡体系(Ⅱ)产生的OH-与酸反应,消耗了加入的H+,当加入少量碱时,平衡体系(Ⅰ)的NH4+与碱反应,消耗了加入的OH-,从而可在一定范围内维持溶液pH大致不变。类似的缓冲溶液由CH3COONa-CH3COOH。 (5) 沉淀①为氢氧化铝和氢氧化铁,加入过量氢氧化钠后溶液③为偏铝酸钠,沉淀②为氢氧化铁沉淀,溶液③中加入足量的盐酸,得到的溶液④为氯化铝溶液,在AlCl3饱和溶液中存在溶解平衡:AlCl3·6H2O(s) Al3+(aq) +3Cl—(aq) +6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
Al3+(aq) +3Cl—(aq) +6H2O(l),通入HCl气体使溶液中c(Cl—)增大,平衡向析出固体的方向移动从而析出AlCl3晶体。
考点:盐类的水解。
本题难度:困难