时间:2017-01-16 15:41:51
1、选择题 美国科学家将两种元素Pb和Kr的原子核对撞,获得了一种质子数为118,中子数为175的超重元素。该元素原子核内的中子数与核外电子数之差是
A.293
B.47
C.61
D.57
参考答案:D
本题解析:试题分析:质子数=核外电子数,所以该元素原子核内的中子数与核外电子数之差是=175-118=57,答案选D。
考点:考查组成原子的微粒之间数量关系的有关计算
点评:该题是高考中的常见题型,属于基础性试题的考查。重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性,难度不大。
本题难度:简单
2、选择题 下列物质在固态时是原子晶体的是
A.二氧化硅
B.硝酸铵
C.磷酸
D.蔗糖
参考答案:A
本题解析:B项硝酸铵属于离子晶体,C项磷酸和D项蔗糖属于分子晶体,只有A项二氧化硅属于原子晶体,符合题意。
本题难度:简单
3、选择题 电子数相等的微粒叫做等电子体,下列各组微粒属于等电子体是
A.CO和CO2
B.NO和NO2
C.CH4和NH3
D.CO2和SO2
参考答案:C
本题解析:C中电子数相等,都是10电子,其他选项都是错误的,所以答案选C。
本题难度:一般
4、选择题 把1mL0.1mol/L的H2SO4溶液加入蒸馏水中,制成200ml溶液,稀释后的H2SO4中,由水自身电离产生的c(H+)最接近:
A.1×10-13mol/L
B.1×10-3mol/L
C.1×10-7mol/L
D.1×10-11mol/L
参考答案:D
本题解析:由C1V1=C2V2,得:C(稀释后H2SO4)= 5×10-4mol/L,即C酸(H+)= 1×10-3mol/L
(酸性溶液可忽略[H+]水)代入Kw=[H+][OH-],得:[OH-]=1×10-11mol/L=[OH-]水?
因为: H2O 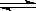 ?H++OH-,所以:[H+]水==[OH-]水=1×10-11mol/L,故选D
?H++OH-,所以:[H+]水==[OH-]水=1×10-11mol/L,故选D
本题难度:一般
5、选择题 下列电离方程式中,正确的是
A.NaHCO3═Na++H++CO32-
B.MgCl2═Mg2++Cl2
C.H2S O4═2H++SO42-
D.KClO3═K++Cl-+3O2-
参考答案:C
本题解析:分析:强电解质的电离不可逆,弱电解质的电离可逆,离子团不能拆开.
解答:A、碳酸钠中的碳酸氢根离子团不能拆开来写,应为NaHCO3═Na++HCO3-,故A错误;
B、MgCl2不能电离出氯气分子,应为MgCl2═Mg2++2Cl-,故B错误;
C、硫酸是强酸,属于二元酸,完全电离出两个氢离子和硫酸根离子,故C正确;
D、氯酸钾中的氯酸根离子团不能拆开,应为KClO3═K++ClO3-,故D错误.
故选C.
点评:本题考查了学生电离方程式的书写方法,注意离子团不能拆开这一细节,难度不大.
本题难度:简单