时间:2017-01-16 15:25:56
1、填空题 (16分)直接排放煤燃烧产生的烟气会引起严重的环境问题,将烟气通过装有石灰石浆液的脱硫装置可以除去其中的二氧化硫,最终生成硫酸钙。硫酸钙可在下图所示的循环燃烧装置的燃料反应器中与甲烷反应,气体产物分离出水后得到几乎不含杂质的二氧化碳,从而有利于二氧化碳的回收利用,达到减少碳排放的目的。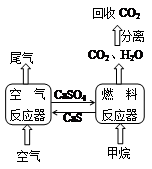
请回答下列问题:
(1)煤燃烧产生的烟气直接排放到空气中,引发的主要环境问题有??????????。(填写字母编号)
A.温室效应
B.酸雨
C.粉尘污染
D.水体富营养化
(2)在烟气脱硫的过程中,所用的石灰石浆液在进入脱硫装置前,需通一段时间二氧化碳以增加其脱硫效率;脱硫时控制浆液的pH值,此时浆液含有的亚硫酸氢钙可以被氧气快速氧化生成硫酸钙。
①二氧化碳与石灰石浆液反应得到的产物为?????????????。
②亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为???????????????????。
(3)已知1mol CH4在燃料反应器中完全反应生成气态水时吸收?160.1kJ,1mol CH4在氧气中完全燃烧生成气态水时放热802.3kJ。写出空气反应器中发生的热化学方程式:?????????????????????????????????????????。
(4)回收的CO2与苯酚钠在一定条件反应生成有机物M,其化学式为C7H5O3Na,M经稀硫酸酸化后得到一种药物中间体N,N的结构简式为 。
。
①M的结构简式为??????????????????。
②分子中无—O—O—,醛基与苯环直接相连的N的同分异构体共有????????种。
参考答案::(1)ABC(3分)(2)①Ca(HCO3)2或碳酸氢钙(
本题解析::(1)煤燃烧产生的烟气主要有CO2、CO、SO2和粉尘,直接排放到空气中,CO2引起温室效应,SO2引起酸雨,粉尘引起粉尘污染,故选ABC。
(2)①二氧化碳与石灰石浆液反应得到的产物为碳酸氢钙,②亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为Ca(HSO3)2+O2=CaSO4↓+ H2SO4。
(3)CH4在燃料反应器中的反应为CH4(g) +CaSO4(s)="CaS(s)+" CO2(g)+2H2O(g),△H1=+?160.1Kj/mol
CH4在氧气燃烧反应
本题难度:一般
2、选择题 下列叙述正确的是(?????)
A.预测PCl3的立体构型为平面三角形
B.SO2和CO2都是含有极性键的非极性分子
C.在NH和[Cu(NH3)4]2+中都存在配位键
D.铝元素的原子核外共有5种不同运动状态的电子
参考答案:C
本题解析:PCl3的中心原子含有1对孤电子对数,所以是三角锥形,A不正确。SO2的中心原子含有2对孤电子对数,所以是V形结构,B不正确。铝元素的原子核外有13个电子,因此就有13种不同运动状态的电子,D不正确。所以答案选C。
本题难度:一般
3、选择题 xR2++yH++O2=mR3++nH2O中,对m和R2+、R3+判断正确的是
A.m=4,R2+是氧化剂
B.2m=y,R3+是氧化剂
C.m=4,R2+是还原剂
D.m=,R3+是还原剂
参考答案:C
本题解析:分析:在离子方程式中遵循电荷守恒和原子守恒,可以净水m、x、y、n的值进行判断,化合价升高元素所在的生成物是氧化产物,化合价降低元素所在的生成物是还原产物.根据化合价的升降分析氧化剂、还原剂、氧化产物、还原产物等概念.
解答:根据氧原子守恒,所以n=2,根据氢原子守恒,所以y=4,根据R原子守恒则x=m,根据电荷守恒则2x+y=3m,所以x=y=m,在反应中,R的化合价升高,R2+是还原剂,所以R3+是氧化产物,氧元素化合价降低,所以H2O是还原产物.
A、m=4,R2+是还原剂,故A错误;
B、x=y,R3+是氧化产物,故B错误;
C、m=4,R2+是还原剂,故C正确;
D、m=Y,R3+不是还原剂,是氧化产物,故D错误;
故选C.
点评:本题考查学生氧化还原反应中的概念和原子守恒、电荷守恒的知识,可以根据所学知识进行回答,难度不大.
本题难度:困难
4、选择题 有关键能(破坏1 mol共价键吸收的能量)数据如表
| 化学键 | Si—O | O===O | Si—Si |
| 键能/kJ·mol-1 | X | 498.8 | 176 晶体硅在氧气中燃烧的热化学方程式为Si(s)+O2(g)===SiO2(s) ΔH=-989.2 kJ·mol-1,则X的值为(已知1 mol Si中含有2 mol Si—Si键,1 mol SiO2中含有4 mol Si—O键) A.423.3 B.460 C.832 D.920 参考答案:B 本题解析: 本题难度:一般 5、选择题 反应:Cr2O72-+3SO32-+aH+=2Cr3++3Y+4H2O下列说法不正确的是 参考答案:C 本题解析:分析:因Cr元素的化合价降低,则S元素的化合价升高,所以Y为SO42-,然后利用电荷守恒可确定a,利用化合价降低的物质为氧化剂发生还原反应及化合价的变化计算转移的电子数. 本题难度:简单 |