时间:2017-01-16 15:23:37
1、简答题 (1)已知常温下,AgBr的Ksp=4.9×10-13、AgI的Ksp=8.3×10-17.现向含有AgI的饱和溶液中:
①加入固体AgNO3,则c(I-)______(填“变大”、“变小”或“不变”,下同).
②若改加更多的AgI固体,则c(I-)______,而c(Ag+)______.
③若改加AgBr固体,则c(I-)______,而c(Ag+)______.
(2)难溶弱电解质在水溶液中既存在溶解平衡又存在电离平衡.已知Cu(OH)2?Cu2++2OH-,KSP=c(Cu2+)?[c(OH-)]2=2×l0-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.某
CuSO4溶液里c(Cu2+)=0.02mol?L-1,如要生成Cu(OH)2沉淀,应调整沉淀pH使之大于______.
参考答案:(1)①加入AgNO3固体,使c(Ag+)增大,AgI溶解平
本题解析:
本题难度:一般
2、选择题 已知4种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为: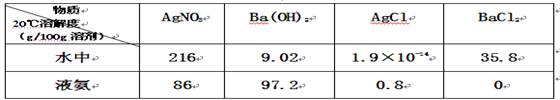
由此溶解度可知在水溶液中上述化合物发生复分解反应为:2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2,那么上述几种化合物在液氨溶液中发生复分解反应的化学方程式(?)
A.2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2
B.2AgNO3+BaCl2=2AgCl+Ba(NO3)2↓
C.2AgCl+Ba(NO3)2=2AgNO3↓+BaCl2
D.2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓
参考答案:D
本题解析:根据反应的特点可判断,反应的生成物至少有一种溶解度很小。在液氨中氯化钡的溶解度为0,所以在液氨中的反应应是2AgCl+Ba(NO3)2=2AgNO3+BaCl2↓,答案选D。
本题难度:一般
3、选择题 下列有关电解质溶液中粒子浓度关系正确的是
A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-)
B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-)
C.pH相等的①NH4Cl ②(NH4)2SO4③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③
D.含等物质的量的NaHC2O4和Na2C2O4的溶液: 3c(Na+)=2[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)]
参考答案:A
本题解析:
试题分析:A.pH=1的NaHSO4溶液中根据电荷守恒c(Na+)+c(H+)=2c(SO42-)+c(OH-)以及物料守恒c(Na+)=c(SO42-)可知c(H+)=c(SO42-)+c(OH-),A正确;B.碘化银的溶度积常数小于氯化银的,则含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)>c(I-),B错误;C.铵跟水解溶液显酸性,氢离子抑制铵跟的水解,则pH相等的①NH4Cl ②(NH4)2SO4③NH4HSO4溶液中:c(NH4+)大小顺序:①=②>③,C错误;D.含等物质的量的NaHC2O4和Na2C2O4的溶液中根据物料守恒可知2c(Na+)=3[c(HC2O4-)+ c(C2O42-)+c(H2C2O4)],D错误,答案选A。
考点:考查溶液中离子浓度大小比较
本题难度:一般
4、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.b点有BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
参考答案:A、硫酸钡溶液中存在着溶解平衡,a点在平衡曲线上,加入Na2
本题解析:
本题难度:一般
5、选择题 下述根据下列操作和现象,所得结论正确的是
| | 实验操作及现象 | 实验结论 |
| A | 分别向2mL0.1mol·L-1CH3COOH溶液和2mL0.1mol·L-1H3BO3溶液中滴加等浓度的NaHCO3溶液,前者有气泡产生,后者无明显现象 | 酸性:CH3COOH>H2CO3>H3BO3 |
| B | 向浓度均为0.1mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀 | 溶度积:Ksp(AgCl)<Ksp(AgI) |
| C | 向无水乙醇中加入浓H2SO4,加热,产生的气体通入酸性KMnO4溶液,紫色褪去 | 证明生成了乙烯 |
| D | 将少量的溴水滴入NaI溶液中,再滴加CCl4,振荡、静置,溶液分为两层:上层溶液无色,下层溶液紫红色 | 氧化性:Br2>I2 参考答案:AD 本题解析: 本题难度:困难 |