时间:2017-01-15 17:51:03
1、填空题 某同学查阅资料得知,①草酸晶体(H2C2O4·2H2O)在175℃时受热分解,同时熔化且熔融时易挥发。②草酸晶体易溶于水,而草酸钙难溶于水。
为验证草酸分解的产物,该同学选择如下仪器和试剂中的部分完成此实验。
(1)草酸晶体受热分解的方程式为???????????????????????????????。
(2)草酸晶体受热分解时,选择的装置为???????,理由是??????????????。
(3)若只验证CO2气体一种产物时,除气体发生装置外所选择装置的接口顺序为????。
(4)若验证所有的产物时,除气体发生装置外所选择的必要装置的接口顺序为??????。
(5)草酸晶体使酸性高锰酸钾溶液褪色的化学方程式为?????????????????????????。
参考答案:⑴ 本题解析:略
本题难度:一般
2、实验题 在高温时硫铁矿(主要成分FeS2)和氧气反应生成三氧化二铁和二氧化硫(假设硫铁矿中的杂质不参与化学反应)。某化学研究学习小组对硫铁矿样品进行如下实验探究:
【实验一】测定硫元素的含量
I.实验装置如下图所示(夹持和加热装置已省略)。A中的试剂是双氧水,将m·g该硫铁矿样品放人硬质玻璃管D中。从A向B中逐滴滴加液体,使气体发生装置不断地缓缓产生气体,高温灼烧硬质玻璃管D中的硫铁矿样品至反应完全。
II.反应结束后,将E瓶中的溶液进行如下处理: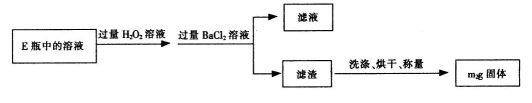
【实验二】测定铁元素的含量
III.测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解已冷却的硬质玻璃管D中的固体,过滤,得到滤液A;
②在滤液A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
③将滤液B稀释为250 mL;
④取稀释液25.00 mL,用浓度为c mol/L的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体
积的平均值为V mL。
请根据以上实验,回答下列问题:
(1)I中装置C中盛装的试剂是_??????????;E瓶的作用是_??????????。
(2)11中加入过量H2O2溶液发生反应的离子方程式为____。
(3)111的步骤③中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,
还必须要用到的是_??????????;④中盛装KMnO3溶液的仪器是_??????????。
(4)假设在整个实验过程中硫元素和铁元素都没有损失,则该硫铁矿样品中硫元素的质量分数为_??????????。(用含m1和m2的代数式表示);铁元素的质量分数为____。(用含m1、c、v的代数式表示)
参考答案:(14分)(1)浓硫酸(1分);吸收二氧化硫(2分)(2)H
本题解析:
试题分析:(1)A中盛有双氧水,说明该装置是制备氧气的。由于氧气中含有水蒸气,所以C中盛装的试剂是浓硫酸,用来干燥氧气;硫铁矿样品和氧气在高温下反应生成SO2,所以E中氢氧化钠溶液的作用是吸收二氧化硫。
(2)氢氧化钠溶液吸收二氧化硫生成亚硫酸钠,所以11中加入过量H2O2的目的是氧化亚硫酸钠,生成硫酸钠。因此溶液中发生反应的离子方程式为H2O2+SO32-=SO42-+H2O.
(3)111的步骤③中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,
还必须要用到的是250mL容量瓶;④中取稀释液25.00ml,溶液是酸性溶液,体积数据要求到小数点后两位,需用的仪器是酸式滴定管,所以④中盛装KMnO3溶液的仪器是酸式滴定管。
(4)最终所得沉淀是硫酸钡,根据硫原子守恒得硫的质量,设硫的质量为x,则
S——BaSO4
32g?? 233g
x????m2g
解得x=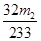 g
g
所以质量分数=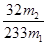 ×100%
×100%
高锰酸钾的还原产物是Mn2+,在反应中得到7-2=5个电子。而Fe2+在反应中失去1个电子,所以根据电子的得失守恒可知,在25.00ml溶液中亚铁离子的物质的量是cmol/L×0.001VL×5=0.005cVmol,所以铁元素的质量分数=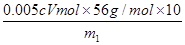 ×100%=
×100%=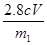 ×100%
×100%
本题难度:一般
3、实验题 (10分)某中学化学实验小组为了证明和比较SO2与氯水的漂白性,设计了如下装置: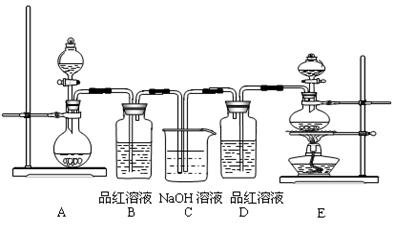
(1)实验室常用装置E制备Cl2,指出该反应中浓盐酸所表现出的性质______、_______。????????????????????????????????????
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为:B ?????????????????, D_________________。
(3)装置C的作用是________________________________。
(4)该实验小组的甲、乙两位同学利用上述两发生装置按下图装置继续进行实验: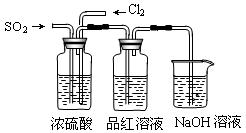
通气一段时间后,甲同学实验过程中品红溶液几乎不褪色,而乙同学的实验现象是品红溶液随时间的推移变得越来越浅。
试根据该实验装置和两名同学的实验结果回答问题。
①试分析甲同学实验过程中,品红溶液不褪色的原因是:????????????????????
???????????????????????????????。
②你认为乙同学是怎样做到让品红溶液变得越来越浅的?
??????????????????????????????????????????????????????????????????
参考答案:(10分)(1)酸性(1分)、还原性(1分);
(2)
本题解析:略
本题难度:一般
4、实验题 (15分)某研究小组探究SO2和Fe(NO3)3溶液的反应。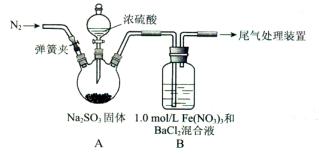
已知:1.0 mol/L的Fe(NO3)3溶液的pH=l
请回答:
(1)装置A中反应的化学方程式是____________。
(2)为排除空气对实验的干扰,滴 加浓硫酸之前应进行的操作是___________。
(3)装置B中产生了白色沉淀,其成分是____________,说明SO2具有________性。
(4)分析B中产生白色沉淀的原因:
观点1.____________;
观点2:SO2与Fe3+反应;
观点3:在酸性条件下SO2与NO3-反应;
①按观点2,装置B中反应的离子方程式是___________,为证明该观点应进一步检验生成的新物质,其实验操作及现象是__________。
②按观点3,只需将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验。应选择的试剂是(填序号)____________。
a.0.1 mol/L稀硝酸???????
b.1.5 mol/L Fe(NO3)2溶液
c.6.0 mol/L NaNO3和0.2 mol/L盐酸等体积混合的溶液
参考答案:(1)Na2SO3+H2SO4(浓) = Na2SO4+ S
本题解析:(1)浓硫酸和亚硫酸钠反应生成SO2,方程式为Na2SO3+H2SO4(浓) = Na2SO4+ SO2↑+H2O。
(2)要排除空气对实验的干扰,则就需要排尽装置中的空气。可利用氮气来排尽装置中的空气,即打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹。
(3)B中溶液显酸性,因此不可能是亚硫酸钡沉淀,只能是硫酸钡沉淀。这说明SO2被氧化生成了硫酸产生的,因此SO2具有还原性。
(4)根据观点2、3可知,观点1应是SO2和Fe3+、酸性条件下NO3-都反应。
①如果是②,则铁离子的还原产物是亚铁离子,所以方程式为O2+ 2Fe3++Ba2++2H2O==
BaSO4↓+2Fe2++4H+。要检验亚铁离子,可利用其还原性进行检验,即取少量B溶液于试管中,加入少量的酸性KMnO4溶液,紫色褪去则溶液中有Fe2+。如果NO3-氧化了SO2,则其还原产物是NO,NO具有氧化性,可以利用湿润的淀粉KI试纸,即用湿润的淀粉KI试纸靠近B导管末端,若不变蓝,说明NO3-没反应则证明观点2合理。
②为排除铁离子的干扰,可以选择不含铁离子的硝酸盐即可,所以答案选C。
本题难度:一般
5、实验题 (14分)室温下,将一定浓度的Na2CO3溶液滴入CuSO4溶液中得到了蓝色沉淀。为了确定该沉淀的组成,某研究性学习小组进行了以下实验和研究。
(一)【提出假说】
假设一:两者反应只生成CuCO3沉淀;
假设二:两者反应只生成Cu(OH)2沉淀;
假设三:?????????????????????????????????。
(二)【理论探究】
假设二中只生成Cu(OH)2的原因是?????????????????????????????(用一个离子方程式表示)。
查阅资料:CuCO3和Cu(OH)2均不带结晶水;
(三)【实验探究】
步骤一:将CuSO4溶液加入到等浓度等体积的Na2CO3溶液中并搅拌,有蓝色沉淀生成。
步骤二:将沉淀从溶液中分离出来。
步骤三:利用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(1)各装置连接顺序为 ?????????????????????。
(2)装置C中装有试剂的名称是????????????????????????????。
(3)能证明生成物中有CuCO3的实验现象是???????????????????????。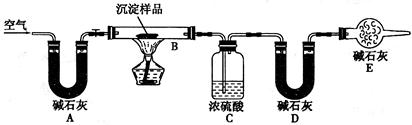
步骤四:??步骤三:利用下图所示装置,进行定量分析:
(4)①A装置中玻璃仪器的名称是????????????。
②实验开始时和实验结束时都要通入过量的空气其作用分别是????????????????????????
??????????????????????和??????????????????????????????????????????????。
数据记录:
| ? | B装置中样品的质量(g) | C装置的质量(g) | D装置的质量(g) |
| 实验前 | 33.3 | 262.1 | 223.8 |
| 试验后 | 24 | 264.8 | 230.4 (四)【实验结论】 利用上述数据初步判断该沉淀的成分是CuCO3和Cu(OH)2,若所得沉淀是纯净物而不是混合物,通过计算写出该物质的化学式????????????????。 参考答案:(14分) 本题解析: 本题难度:简单 |