时间:2017-01-15 17:50:23
1、选择题 在“绿色化学”工艺中,理想状态是反应物中的原子全部能转化为目标产物,即原子利用率为100%.在下列反应类型中,能体现这一原子最经济性原则的是( )
A.化合反应
B.分解反应
C.置换反应
D.复分解反应
参考答案:A.化合反应是多种物质生成一种物质,反应物中的所有原子都转化
本题解析:
本题难度:一般
2、填空题 .(21分)合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  ?2NH3(g)??△H= -92.4KJ/mol??,据此回答以下问题:
?2NH3(g)??△H= -92.4KJ/mol??,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)?????????。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应的活化能降低,加快反应速率
d.活化分子间所发生的碰撞为有效碰撞
e.降低温度,V正、V逆均减小且V正减小的倍数小于V逆减小的倍数。
f.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡影响规律知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是???????????????(填字母)。
a.容器内的密度保持不变??????????????
b.容器内压强保持不变????
c.υ正(N2)=2υ逆(NH3)????????????
d.混合气体中c(NH3)不变
e.容器内混合气体的平均摩尔质量保持不变
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。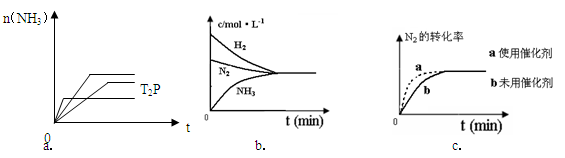
 (5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1mol N2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a_____b(填>、=、<), Q1_____ Q2(填>、=、<), Q1_____92.4(填>、=、<)。
参考答案:(1)a、c、f、e、??(4分)
(2)①
本题解析:(1)增大压强能增大单位体积内活化分子百分数,所以能增大反应速率,b不正确。活化分子间所发生的碰撞不一定都是有效碰撞,把能够发生化学变化的碰撞称为有些碰撞,d不正确,其余都是正确的,答案选acef。
(2)①平衡常数是在一定条件下,可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度幂之积的比值,所以表达式为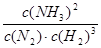 本题难度:一般
本题难度:一般
3、选择题 酸雨的主要成分是H2SO4,以下是形成途径之一:NO2+SO2→NO+SO3①,2NO+O2→2NO2②,SO3+H2O→H2SO4③
以下叙述错误的是?
A.NO2由反应N2+O2NO2生成
B.总反应可表示为2SO2+O2+2H2O2H2SO4
C.还可能发生的反应有4NO2+O2+2H2O→4HNO3
D.还可能发生的反应有4NO+3O2+2H2O→4HNO3
参考答案:A
本题解析:分析:A.根据N2+O2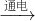 2NO;
2NO;
B.根据①×2+②+③×2;
C.根据3NO2+H2O═2HNO3+NO④以及④×2+②;
D.根据3NO2+H2O═2HNO3+NO④以及④×2+②×3;
解答:A.N2+O2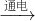 2NO,不能生成NO2,故A错误;
2NO,不能生成NO2,故A错误;
B.①×2+②+③×2得:2SO2+O2+2H2O═2H2SO4,故B正确;
C.利用3NO2+H2O═2HNO3+NO④以及④×2+②得:4NO2+O2+2H2O═4HNO3,故C正确;
D.利用3NO2+H2O═2HNO3+NO④以及④×2+②×3得:4NO+3O2+2H2O→4HNO3,故D正确;
故选:A.
点评:本题主要考查了方程式的书写,难度不大,根据课本知识即可完成.
本题难度:简单
4、选择题 下列不需要用到二氧化硅的是
A.光导纤维
B.计算机芯片
C.石英钟表
D.玛瑙手镯
参考答案:B
本题解析:略
本题难度:一般
5、选择题 “绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是 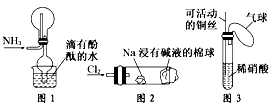 [???? ]
[???? ]
①实验室收集氨气采用图1所示装置
②实验室中做氯气与钠反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A.②③④
B.①②③
C.①②④
D.①③④
参考答案:C
本题解析:
本题难度:一般