时间:2017-01-15 17:44:10
1、选择题 25℃时,浓度均为1 mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液中c(X-)=1 mol/L,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是
A.AY溶液的pH小于7
B.AY溶液的pH小于BY溶液的pH
C.稀释相同倍数,BX溶液的pH变化小于BY溶液
D.电离平衡常数K(BOH)小于K(HY)
参考答案:D
本题解析:A项,根据AX、BX、BY溶液的pH,则AX为强酸强碱盐,BX为强酸弱碱盐,BY为弱酸弱碱盐,则AY为强碱弱酸盐,溶液的pH>7;B项,AY溶液的pH>7而BY溶液的pH=6;C项,稀释相同倍数,BX、BY溶液的pH均增大,BX溶液的pH变化大于BY溶液;D项,根据BY溶液的pH=6,BOH的碱性小于HY的酸性,因此电离平衡常数K(BOH)小于K(HY)。
本题难度:一般
2、选择题 欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,其方法是[???? ]
A.加水
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水溶液
参考答案:D
本题解析:
本题难度:一般
3、选择题 下列溶液中微粒浓度关系一定正确的是
参考答案:C
本题解析:A 错误,将水加热,只是水的电离程度增大,但c(H+)=c(OH-)
B 错误,C(CH3COO-)=C(Na+)
C 正确
D 错误,如果是强酸,c(H+)=c(OH-),如果是弱酸,c(H+)>c(OH-).
本题难度:一般
4、选择题 下列说法正确的是(??)
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(N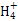 )>c(Cl-)
)>c(Cl-)
C.0.1 mol·L-1的氯化铵溶液与0.05 mol·L-1的氢氧化钠溶液等体积混合后溶液中离子浓度的大小关系是:c(Cl-)>c(N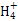 )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)
D.0.1 mol·L-1硫化钠溶液中离子浓度的关系:c(Na+)=c(S2-)+c(HS-)+c(H2S)
参考答案:C
本题解析:CH3COONa溶液中由于CH3COO-水解显碱性,同时生成CH3COOH,A错;根据溶液电中性,c(N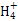 )+c(H+)=c(Cl-)+c(OH-),由溶液的pH=7,可知c(H+)=c(OH-),故c(N
)+c(H+)=c(Cl-)+c(OH-),由溶液的pH=7,可知c(H+)=c(OH-),故c(N本题难度:一般
5、选择题 在
 溶液中,下列关系中不正确的是
溶液中,下列关系中不正确的是
A.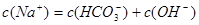
B.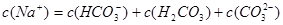
C.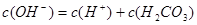 -c(CO32-)
-c(CO32-)
D.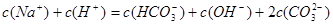
参考答案:A
本题解析:略
本题难度:简单